Introducción
Se trata de una granja comercial de ciclo cerrado en Irlanda que aumentó de 600 a 1.000 cerdas en un año.

El protocolo de vacunación utilizado se ilustra en la tabla 1.
Tabla 1. Programa de vacunación.
| Vacuna | Nulíparas | Cerdas | Verracos | Lechones |
| Parvovirus | Inyección 2 ml el día de selección | Inyección 2 ml 2 semanas post parto | Inyección 2 ml dos veces al año | |
| Erisipelas | Inyección 2 ml el día de selección y 2 semanas antes de la cubrición | Inyección 2 ml 2 semanas post parto | Inyección 2 ml dos veces al año | |
| Colibacilosis y Clostridiosis | Inyección 2 ml 6 y 2 semanas antes del parto | Inyección 2 ml 2 semanas antes del parto | ||
| PRRS (viva atenuada, o MLV) | Inyección 2 ml el día de selección y a los 60 días post cubrición | Inyección 2 ml 6 días post parto y a los 60 días post cubrición | Inyección 2 ml dos veces al año | |
| PCV-2 | Inyección 1 ml al destete | |||
| Neumonía enzoótica | 1 ml a los 10 - 14 días y al destete |
Las nulíparas proceden de la propia explotación. Los verracos se usan para recelar. Las nulíparas y las cerdas se cubren mediante inseminación artificial con semen de un único proveedor.
La granja más próxima está a 2 km.
Historial
El ganadero contactó al veterinario por un aumento de problemas respiratorios, pérdida de condición corporal y un aumento de la mortalidad en la transición y el engorde.
Investigación
Investigación clínica
Durante una visita a la granja en septiembre de 2017, se detectaron muchos cerdos de 6 a 15 semanas de edad con signos clínicos de pérdida de condición corporal y respiración abdominal (figuras 1 y 2). Había muy poca tos. La densidad en los corrales era excesiva.

Figura 1. Corral de cerdos en transición con una densidad excesiva que muestran signos clínicos de pérdida de condición corporal.

Figura 2. Animales con signos clínicos de pérdida de condición corporal.
El ganadero comentó que la mortalidad entre el destete y el engorde estaba entre 3,5 – 5%. Sin embargo, la mortalidad anotada en la pizarra de la granja era totalmente diferente (figura 3).
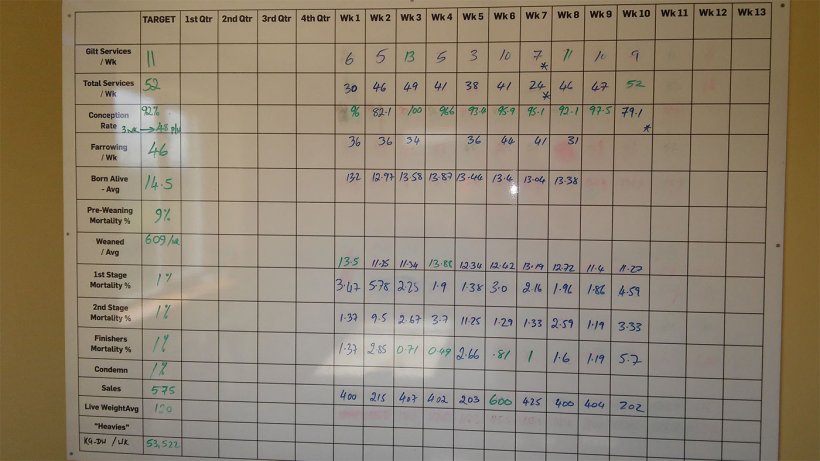
Figura 3. Rendimiento semanal de la unidad a septiembre de 2017.
Según la pizarra, la mortalidad del destete y el engorde fue del 8,48% durante las últimas 10 semanas. Esta mortalidad se dividía en 2,64 % en la primera fase (4 - 9 semanas de vida); 3,82 % en la segunda fase (10 - 15 semanas de vida); y 1,83 % en el acabado (desde las 16 semanas hasta el matadero).
Investigación en laboratorio
Se eutanasiaron dos lechones de 6 semanas de edad con respiración abdominal y pérdida de condición corporal para necropsiarlos en la granja (figura 4 y vídeo 1). Se tomaron muestras que se mandaron al laboratorio para su análisis.

Figura 4. Lechón en el destete con estrés respiratorio y retraso en el crecimiento.
Vídeo 1. Lechón en transición retrasado y con dificultad respiratoria.
La tabla 2 resume los resultados de la necropsia y del laboratorio. Las figuras 5, 6, 7 y 8 muestran los hallazgos de la necropsia.
Tabla 2. Resultados laboratoriales de los dos lechones de 6 semanas en transición.
| Lechón | Necropsia | Hallazgos bacteriológicos | Hallazgos biomoleculares | Histología |
| 1 | Mala condición corporal. Bajo peso. Pericarditis. Pleuritis. Consolidación pulmonar del área ventral de los lóbulos cardíaco y diafragmático con neumonía instersticial. |
Pasteurella multocida (pulmón). Streptococcus suis serotipo 3 (pulmón). |
Negativo a Mycoplasma hyopneumoniae, Virus influenza tipo A y PCV-2 mediante RT-PCR (pulmón). EU-PRRS positivo mediante RT-PCR (CT: 21.2) pool de los pulmones de ambos lechones. |
Bronquios con granulocitos neutrofílicos e hiperplasia del epitelio bronquial. El tejido pulmonar muestra distintas fases de bronconeumonía fibrinosa. Por lo tanto se detecta, con frecuencia, hepatización y carnificación. En el espacio interlobular y interalveolar hay proliferación de tejido fibroso multifocal. Estos hallazgos son representativos de inflamación crónica. |
| 2 | Mala condición corporal. Bajo peso. Aumento de tamaño de los linfonodos inguinales. Pericarditis. Pleuritis. Consolidación pulmonar del área ventral de los lóbulos cardíaco y diafragmático con neumonía instersticial. |
Pasteurella multocida (pulmón). | Negativo a Mycoplasma hyopneumoniae, Virus influenza tipo A y PCV-2 mediante RT-PCR (pulmón). EU-PRRS positivo mediante RT-PCR (CT: 21.2) pool de los pulmones de ambos lechones. |
Signos de inflamación crónica en pulmones. La inflamación es principalmente de tipo catarral-purulento. Los bronquios están llenos de granulocitos neutrofílicos y el epitelio bronquial está hiperplásico. La cronicidad se caracteriza por la proliferación de tejido fibroso en los espacios intersticiales. La pleura está focalmente hiperplásica y puede detectarse edema intersticial. |
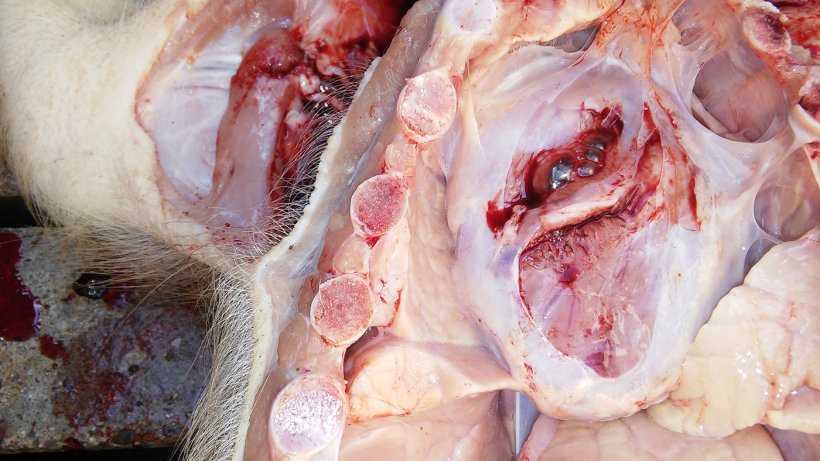
Figura 5. Pericarditis.
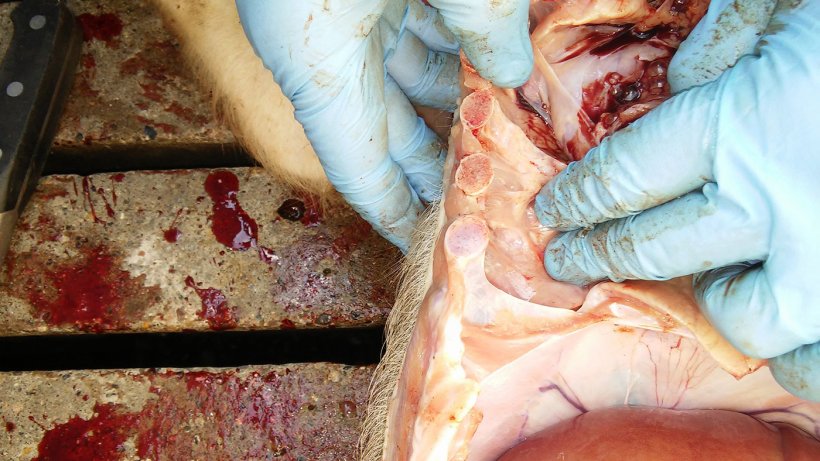
Figura 6. Pleuritis entre la pleura pulmonar y la costal.

Figura 7. Neumonía interstitial con una consolidación pulmonar marcada del lóbulo diafragmático ventral.
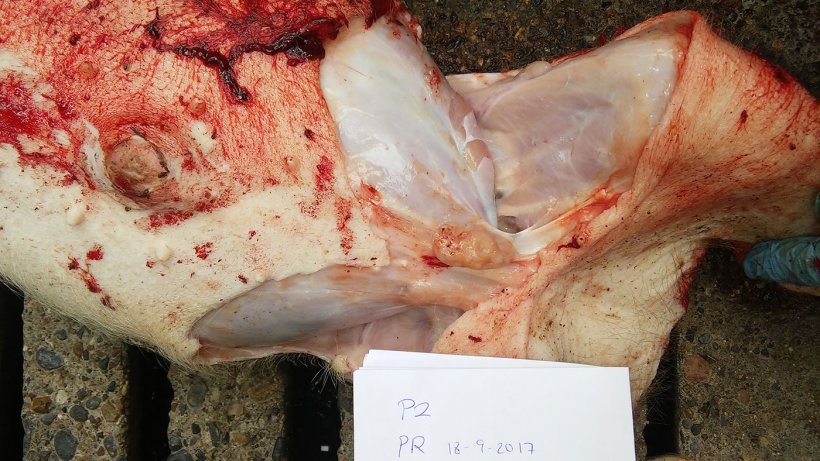
Figura 8. Linfonodo mesentérico aumentado de tamaño.
Diagnóstico diferencial
En base a las investigaciones clínicas y laboratoriales, se realizaron los siguientes diagnósticos diferenciales:
- PRRS (Síndrome Respiratorio y Reproductivo Porcino).
- PCV2 (Circovirus Porcino tipo 2).
- Virus Influenza tipo A.
- Pneumonia Enzoótica (Mycoplasma hyopneumoniae).
En base a los resultados laboratoriales negativos, se descartaron los agentes virales como el virus de la influenza tipo A y PCV-2. El protocolo vacunal frente a PCV-2 fue satisfactorio en esta unidad.
También se descartó la neumonía enzoótica por los resultados laboratoriales, el programa vacunal satisfactorio y la falta de tos en el engorde.
En base al historial y a los resultados laboratoriales consistentes, se pensó en PRRS con una infección bacteriana oportunista en el engorde.
Programa de control
Se sugirió la vacunación con una vacuna MLV-PRRS para todos los lechones de 10 – 14 días.
Respuesta al programa de control
Hubo una reducción de los problemas respiratorios y de lechones retrasados. Tres meses después, la mortalidad se redujo considerablemente hasta el 5,2 %. Esta mortalidad se dividía en 2,25 % en la primera etapa (4 a 9 semanas de vida); 1,72 % e la segunda (10 a 15 semanas); y 1,24 % en el acabado (de las 16 semanas hasta el matadero) (figura 10). La densidad no se modificó.

Figura 10. Rendimiento semanal de la unidad a febrero de 2018.
Discusión
A finales de los 1980s, se describieron graves desórdenes reproductivos y respiratorios en EEUU (Keffaber 1989). En ese momento, el agente etiológico era desconocido. En 1990 se describió el mismo síndrome en Alemania 1990 (OIE 1992). En 1991 se aisló el agente etiológico en Holanda (Wensvoort et al. 1991) y se denominó Síndrome Respiratorio y Reproductivo Porcino (PRRS) (Terpstra et al. 1991).
La infección por PRRS se diagnosticó por primera vez en Irlanda del Norte en 1997 (anónimo, 1997) y en la República de Irlanda en 1999 (Ohlinger et al.2000).
PRRS se encuentra en la mayoría de países productores del mundo con unas pocas excepciones: Suecia (Carlsson et al. 2009), Noruega (OIE 1997), Finlandia (Bøtner 2003), Suiza (Corbellini et al. 2006), Nueva Caledonia (OIE 1996), Nueva Zealand (Motha et al. 1997), Australia (Garner et al. 1997), Argentina (Perfumo y Sanguinetti 2003), Brasil (Ciacci-Zanella et al. 2004) y Cuba (Alfonso y Frias Lepoureau 2003).
La gravedad de la infección por PRRS varía entre granjas. Agentes no infecciosos pueden exacerbar la expresión de los signos clínicos. Estos factores no infecciosos consisten en manejo, flujo de animales, alojamiento y regulación de temperatura (Zimmerman et al. 2012). Las infecciones concurrentes con agentes virales y bacterianas potencian o añaden gravedad a la expresión de los signos clínicos del PRRS (Shibata et al. 2003, Thacker et al. 1999, Borobia et al. 2014). La pleuritis es una de las lesiones que se encuentran en el pulmón de los animales infectados por PRRS (Muirhead and Alexander 1997). El BPEX (2009) encontró que el impacto económico de la pleuritis era importante. El aumento de la prevalencia de la pleuritis estaba asociado con la reducción del peso canal y el aumento de la edad al sacrificio. El coste para el productor de una prevalencia típica de pleuritis del 10 % se cifró en unas £2,26 (2,59 €) por cerdo.
La vacunación con MLV PRRS ha demostrado ser útil para limitar los efectos del virus de campo en los cerdos destetados (Waddell et al. 2008), como se vio en este caso clínico.






