La recombinación es un proceso natural y un factor determinante de la evolución genética del virus del síndrome reproductivo y respiratorio porcino (vPRRS). Desde finales de los años 90, se ha informado de la aparición de recombinaciones en experimentos de laboratorio con cultivos celulares. Para que tenga lugar la recombinación, dos virus deben infectar una célula y replicarse, intercambiando material genético entre ellos y derivando en un nuevo virus progenie (Figura 1).
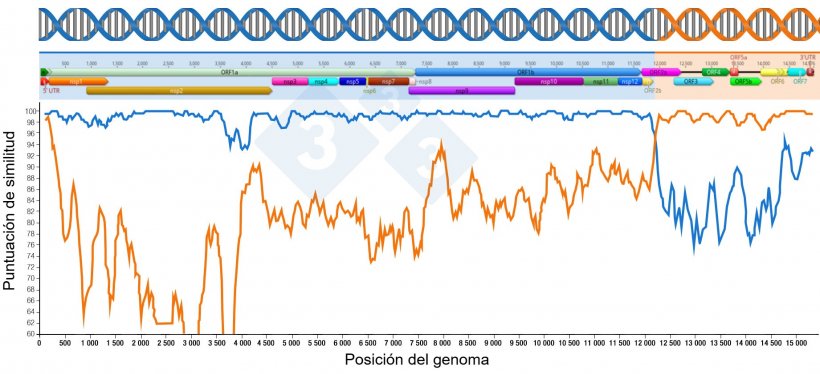

En bibliografía reciente se han reportado recombinaciones producidas entre:
- Virus de campo.
- Virus de vacunas vivas modificadas (MLV -Modified Live Vaccine).
- Entre virus campo y virus vacunales.
Los eventos de recombinación puede que siempre se hayan dado en las granjas, pero lo que ha cambiado en los últimos años es nuestra mejor capacidad para detectarlos mediante el uso creciente de la secuenciación de nueva generación (NGS - Next Generation Sequencing), como se explica en el anterior artículo publicado el 2 de junio de 2025 “Diagnóstico molecular del PRRS: cuando secuenciar solo el 4% no es suficiente”, y la disponibilidad de herramientas bioinformáticas para el análisis de las recombinaciones.
Muchas recombinaciones que tienen lugar en el campo pueden generar virus inviables o virus que no logran establecer una infección estable y persistir en la población. La mayor preocupación para la sanidad animal viene por las recombinaciones entre dos virus campo diferentes (Figura 2).
Las recientes cepas emergentes Rosalía y L1C.5 son ejemplos de cepas agresivas de PRRS que proceden de la recombinación de virus campo y que se han establecido endémicamente en la población porcina causando agresivos signos clínicos.
No obstante, la pregunta que nos queda es:
- ¿Por qué existe la percepción de que hay más vPRRS recombinantes derivados de virus de vacuna viva?
- ¿Qué sucede con estos nuevos virus?
Las recomendaciones del prospecto de las vacunas vivas modificadas indican su uso en animales sanos con el fin de desarrollar inmunidad individual antes de una infección por un virus campo. En la batalla frente a las cepas de PRRS campo, los virus de vacuna MLV a menudo co-circulan con los virus campo. Los virus recombinantes derivados de cepas vacunales no son tan agresivos como los virus campo o los recombinantes de virus campo (Figura 2).
En los Estados Unidos, hay reportes que describen que la adopción de medidas como reforzar las prácticas de biocontención y bioseguridad para evitar la propagación del virus entre salas de maternidad así como mejorar la inmunidad individual de los lechones, han demostrado resultados prometedores en la reducción de las implicaciones clínicas de estos vPRRS-2 derivados de virus MLV de reciente aparición. En Europa, también se ha informado que, bajo experimentos clínicos, los recombinantes de vPRRS-1 derivados de virus vacunales MLV no son tan leves como los virus MLV ni tan agresivos como los virus campo .Los virus quiméricos recombinantes del vPRRS-2 producidos en el laboratorio entre virus campo y virus MLV inoculados experimentalmente en cerdos, han mostrado signos clínicos menos agresivos en comparación con los virus campo, pero no efectos clínicos tan leves como los virus vacunales (Figura 2). Además, también hay informes donde virus recuperados en las granjas, que se demostró que eran virus recombinantes de campo, entre cepas vacunales y cepas campo han planteado desafíos adicionales para su crecimiento en cultivo celular.
Figura 2: Implicaciones clínicas y capacidad bioinformática para detectar recombinación entre diferentes vPRRS.
| Cepa PRRS | Implicaciones clínicas | Capacidad bioinformática para detectar recombinación |
|---|---|---|
| Virus vivo modificado (MLV) |  |
 |
| Recombinante MLV & MLV | ||
| Recombinante MLV & vPRRS campo | ||
| vPRRS campo | ||
|
Recombinante vPRRS campo & vPRRS campo |
Otro enfoque que se ha utilizado en algunos países para gestionar el vPRRS es implementar la inoculación de virus vivo (LVI- Live Virus Inoculum), que implica recoger muestras (como suero o pulmón) directamente de la granja, confirmar la presencia de vPRRS mediante RT-PCR, diluir las muestras en un medio y exponer a los animales al virus campo presente en la granja.
Los virus campo no están atenuados y en particular, la LVI podría contener, sin saberlo, múltiples cepas de vPRRS, creando una oportunidad para la recombinación de virus campo.
Por otra parte, el uso de material para LVI no está legalmente aprobado en muchos países y puede contener otros patógenos que circulan en el torrente sanguíneo de los donantes, por ejemplo, circovirus porcino, parvovirus porcino, etc., lo que plantea desafíos adicionales para el control de enfermedades.
¿Cuáles son las implicaciones de tener múltiples cepas y/o recombinantes de PRRS?
- Las granjas de reproductoras infectadas con ≥ 3 cepas de vPRRS tuvieron 1.837 lechones muertos más por cada 1.000 cerdas en comparación con las granjas infectadas con ≤ 2 cepas, lo que respalda el hecho de que cuantas más cepas de vPRRS circulen en la población/granja/cerdos, mayor será el impacto/signos clínicos (cuantas más cepas = peor);
- Las granjas de reproductoras con ≥ 3 cepas de vPRRS detectadas durante la eliminación del virus tardaron 12 semanas más en lograr la estabilidad en comparación con las granjas con ≤ 2 cepas;
- Las granjas donde se identificó una cepa recombinante de PRRS en el momento del brote tuvieron 1.827 lechones muertos más por cada 1.000 cerdas en comparación con las granjas donde no se detectaron cepas recombinantes.
Controlar el PRRS puede ayudar a reducir la aparición de eventos de recombinación
Algunos ejemplos son:
- Evitar la introducción de primerizas infectadas con un vPRRS distinto al que este presente en ese momento en la granja de reproductoras.
- Evitar mezclar lechones y/o cerdos de engorde infectados con diferentes cepas de campo de vPRRS.
- Analizar las muestras para LVI mediante secuenciación de última generación (NGS - next-generation sequencing) antes de la inoculación y evitar el uso de material para LVI que contenga múltiples vPRRS genéticamente distintos.
- Si el material para LVI tiene un virus similar a un virus de vacuna viva modificada, usar el virus MLV extraído de un frasco de vacuna en lugar de un virus de la granja.
- Al usar vacuna viva de PRRS, evitar mezclar o inyectar dos vacunas vivas simultáneamente. También, evitar rotar vacunas vivas de PRRS dentro de una granja o flujo de producción.
- Seguir adecuadamente las recomendaciones de la etiqueta de las vacunas vivas que indican su uso en animales sanos para inducir inmunidad individual antes de una infección esperable por un virus campo.
El virus PRRS es ya de por si un agente patógeno que supone un desafio para la sanidad animal y continúa evolucionando genéticamente con el tiempo. El control del vPRRS no solo mejora la productividad, sino que también reduce las posibilidades de que diferentes virus campo se recombinen y den lugar a otros más virulentos.




