Test disponibles:
Reacción en cadena de la polimerasa (PCR)
- Detecta la presencia de una secuencia específica de ácido nucleico viral (ARN).
- Tipos de muestras: tejidos intestinales, heces, hisopos rectales, fluidos orales, etc.
- Pros:
- Sensibilidad muy alta (puede detectar pequeñas cantidades de virus).
- Detección temprana: los casos agudos deberían ser positivos.
- Se pueden utilizar muchos tipos diferentes de muestras (tejidos intestinales, heces, hisopos rectales, fluidos orales, etc.).
- Coste moderado:
- A menudo se pueden combinar 10 muestras de heces/hisopos o tejido intestinal para reducir el coste y minimizar la pérdida de sensibilidad.
- No se suelen hacer pooles de muestras de fluidos orales debido a que el valor Ct (número de ciclos necesarios para amplificar el RNA viral hasta alcanzar un nivel detectable) será más alto (porque las concentraciones de virus son más bajas), lo que puede comportar una pérdida significativa de sensibilidad.
- Contras:
- Hace falta secuenciación para diferenciar el virus vacunal de la infección por el virus campo.
- La contaminación ambiental puede generar muchos resultados positivos: los cerdos infectados eliminan grandes cantidades de virus.
Ensayo por inmunoabsorción ligado a enzimas (ELISA)

- Detecta la presencia de anticuerpos.
- Tipos de muestras: suero, fluidos orales.
- Pros:
- Los animales permanecen positivos durante varias semanas, especialmente IgA en fluidos orales.
- Puede utilizarse en casos crónicos.
- Contras:
- Puede haber diferencias en la detección entre diferentes pruebas.
- Los animales tardan entre 7 y 14 días en volverse seropositivos.
- No diferencia entre anticuerpos maternales y los de exposición.
- No distingue entre vacunación e infección por virus campo.
- Lo mejor es tener un ELISA que detecte los niveles de IgA, especialmente en los fluidos orales.
Inmunohistoquímica (IHC)
- Detecta la presencia de antígeno viral.
- Tipos de muestra: tejidos intestinales.
- Pros:
- Detecta al virus en el sitio de la lesión (buena prueba de causalidad).
- Permite diferenciar entre cantidades bajas, moderadas y altas de virus presente.
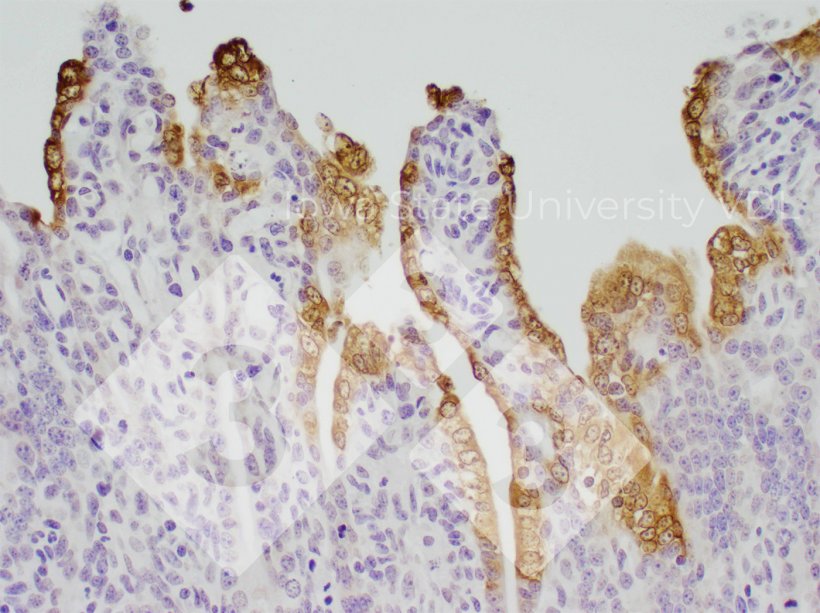
- Contras:
- Tiene que enviarse la muestra de tejido correcta.
- Requiere que haya una cantidad de virus significativamente mayor que la PCR.
- Sólo evalúa una pequeña cantidad de tejido.
- En lechones las vellosidades intestinales se destruyen rápidamente, lo que produce cambios dramáticos en la cantidad de virus presente (tinción) en solo 2 días.
Anticuerpos fluorescentes indirectos (IFA)
- Detecta la presencia de anticuerpos.
- Tipos de muestras: suero.
- Pros:
- Alta sensibilidad para la detección.
- Contras:
- No es factible para números grandes de muestras.
- Los resultados dependen del aislado vírico usado en la prueba.
- La fiabilidad depende mucho de la habilidad de los técnicos y varía significativamente entre laboratorios.
Interpretación de resultados:
PCR
- Positivo: El virus está presente. La vacunación reciente con un virus vivo modificado puede dar resultados positivos en la PCR. Después de la infección se eliminan grandes cantidades de virus (valores Ct muy bajos; un solo dígito), especialmente en cerdos jóvenes. La eliminación y la contaminación ambiental pueden producirse durante un largo periodo de tiempo.
Tabla 1. Los cerdos infectados eliminan grandes cantidades de virus en las heces (valores Ct de un solo dígito en la PCR) lo que provoca una gran contaminación ambiental.
| Ct PCR de DEP versus número de copias genómicas | |
|---|---|
| 42 | 1 |
| 39 | 10 |
| 36 | 100 |
| 32 | 1.000 |
| 29 | 10.000 |
| 26 | 100.000 |
| 22 | 1.000.000 |
| 19 | 10.000.000 |
| 16 | 100.000.000 |
| 12 | 1.000.000.000 |
| 9 | 10.000.000.000 |
| 6 | 100.000.000.000 |
- Negativo: Negativo o el virus no se detecta si la prueba se realiza mucho después de la infección.
ELISA
- Positivo: Anticuerpos maternales o exposición anterior (normalmente > 7-14 días) a vacuna o virus campo.
- Negativo: Negativo, infección demasiado reciente para ser detectada (normalmente debe ser, al menos, 7-14 días post-exposición) o ha pasado demasiado tiempo después de la infección (especialmente si se mide la IgG sérica).
IHC
- Positivo: El virus está presente en el sitio de la lesión.
- Negativo: Negativo o infección demasiado antigua para detectar el virus.
IFA
- Positivo: Anticuerpos maternales o exposición anterior (normalmente > 7-14 días) a vacuna o virus campo.
- Negativo: Negativo a vacuna o virus campo o infección demasiado reciente para ser detectada (normalmente debe ser, al menos, 7-14 días post-exposición).
Escenarios
Diarrea en lechones con mortalidad muy elevada en la sala de maternidad
- Recoge intestinos de 2-5 lechones para pruebas de histología y IHC.
- Recoge intestinos o contenido/hisopos fecales de 5 lechones y analízalos como 1 pool mediante PCR.
Primerizas con diarrea +/- vómitos
- Recoge fluidos orales de 2 a 4 corrales diferentes y analízalos individualmente mediante PCR. No realices pooles de muestras para las pruebas.
- Recoge 10-15 hisopos rectales de cerdas con signos clínicos o toma muestras aleatoriamente y analízalas mediante PCR. Se pueden realizar pools en grupos de 5 para PCR.
Pruebas en primerizas aisladas después de la exposición a virus DEP vivo antes de introducirlas en la granja de reproductoras
- No se recomienda realizar pruebas ya que la contaminación ambiental será alta y las primerizas darán positivo en heces o fluidos orales durante varias semanas, incluso después de que hayan dejado de eliminar el virus y sea seguro introducirlas en la granja de reproductoras.
Cerdos de engorde con diarrea aguda postdestete
- Recoge fluidos orales de 2 a 4 corrales diferentes y analízalos individualmente mediante PCR. No realices pooles de muestras para las pruebas.
- Recoge 10-15 hisopos rectales de cerdas con signos clínicos o toma muestras aleatoriamente y analízalas mediante PCR. Se pueden realizar pools en grupos de 5 para PCR.