Microbiota intestinal y sistema inmunitario
La inmunidad intestinal desempeña un papel central en el mantenimiento de la salud de los cerdos. En animales gnotobióticos, el sistema inmunitario intestinal está subdesarrollado, con deficiencias en la producción de moco, péptidos antimicrobianos y componentes clave como anticuerpos y células T (Gewirtz et al., 2001). La presencia de microbiota asociada a la mucosa intestinal es fundamental para la modulación y maduración inmunitaria (Mulder et al., 2011; Arpaia et al., 2013; Belkaid & Hand, 2014), ya que la mayoría de los genes que influyen en el microbioma están relacionados con el sistema inmunitario. Los elementos inmunitarios del hospedador seleccionan activamente los microorganismos presentes en el lumen intestinal, conformando una microbiota beneficiosa (Honda; Littman, 2016).
Además, los microorganismos comensales pueden:

- metabolizar toxinas alimentarias
- sintetizar vitaminas
- promover la maduración de las células epiteliales intestinales
- y reforzar la función de barrera, favoreciendo la homeostasis inmunitaria.
(Kabat; Srinivasan; Maloy, 2014; Yang et al., 2016; Li et al., 2018; De Vries; Smidt, 2020).
Mecanismos de tolerancia y respuesta frente al microbioma intestinal
El creciente reconocimiento de la microbiota intestinal como factor determinante en el rendimiento porcino ha impulsado avances en el estudio de sus mecanismos de interacción con la inmunidad (Duarte; Kim, 2022). La modulación del microbioma impacta directamente en el desarrollo de la inmunidad y las funciones intestinales (Chen et al., 2018; Li et al., 2018). La densidad bacteriana aumenta a lo largo del tracto gastrointestinal, y el sistema inmunitario debe distinguir los microorganismos patógenos de los comensales e inofensivos (Stokes, 2017). Esta tolerancia selectiva es esencial para evitar reacciones inflamatorias innecesarias y preservar la integridad de la mucosa (Brown; Sadarangani; Finlay, 2013; Mowat, 2018). Por ello, el sistema inmunitario intestinal emplea distintos mecanismos contra el microbioma para asegurar su homeostasis (Figura 1):
Las uniones estrechas son estructuras fundamentales para restringir la permeabilidad transepitelial. Las señales derivadas de los microorganismos refuerzan esta barrera mediante la regulación positiva de sus componentes entre los enterocitos y la modificación de proteínas del citoesqueleto (Bansal et al., 2010).
Los péptidos antimicrobianos (AMPs) también interactúan con la microbiota, contribuyendo a su modulación y promoviendo la eliminación de bacterias comensales próximas al epitelio (Macpherson; Uhr, 2004; Hooper; Littman; Macpherson, 2012).
La expresión de receptores de reconocimiento de patrones (PRRs) es esencial para la homeostasis intestinal. Detectan los MAMPs (patrones moleculares asociados a microorganismos) y regulan la producción de mucina, AMPs, IgA, citocinas, así como el mantenimiento de las uniones estrechas y la proliferación epitelial. Estos ligandos no son exclusivos de los patógenos y son ampliamente producidos por la microbiota comensal durante la colonización saludable (Brown; Sadarangani; Finlay, 2013; Chu; Mazmanian, 2013).
Los receptores tipo Toll (TLRs) reconocen patrones moleculares conservados compartidos por grandes grupos de bacterias y otros microorganismos intestinales (Shi et al., 2017). Diversos estudios han sugerido que los TLRs se expresan estratégicamente en la región basolateral de las células epiteliales intestinales para evitar la exposición directa a la microbiota del lumen. Sin embargo, estudios recientes revelan que también se expresan en la región apical, lo que permite una respuesta rápida de las células de la inmunidad innata incluso si se produce un fallo en el reconocimiento de estos microorganismos (Kayisoglu et al., 2020; Schären; Hapfelmeier, 2021).
Los macrófagos intestinales juegan un papel clave en la tolerancia hacia la microbiota comensal. Expresan un fenotipo hiporreactivo a los ligandos de TLRs, con baja expresión de moléculas coestimuladoras (CD40, CD80, CD86) y alta producción de IL-10 (capacidad antiinflamatoria), además de una reducida síntesis de citocinas proinflamatorias y óxido nítrico. Esto promueve el equilibrio entre linfocitos Th efectores y linfocitos T reguladores, manteniendo la homeostasis (Lopes; Mosser; Gonçalves, 2020).
A pesar de las barreras innatas entre la microbiota y el epitelio, las células dendríticas participan activamente en la regulación inmunitaria. Proyectan dendritas a través de la barrera intestinal para capturar microorganismos en el lumen (Brown; Sadarangani; Finlay, 2013; Shi et al., 2017), promoviendo la producción de IgA secretora y modulando la respuesta inmunitaria (Gonçalves et al., 2016; Zheng; Liwinski; Elina, 2020).
Los microorganismos comensales ocasionalmente atraviesan la capa mucosa del intestino delgado (Ermund et al., 2013). En estos casos, las células dendríticas los presentan a linfocitos B y T, lo que induce la producción de IgA (Chen et al., 2021). Estos linfocitos también están sujetos a mecanismos de tolerancia, ya que expresan receptores específicos para antígenos microbianos (Bailey et al., 2005). Finalmente, la relación entre la IgA y la microbiota es mutualista: un repertorio diverso y bien regulado de IgA contribuye al mantenimiento de un microbioma equilibrado (Gutzeit; Magri; Cerutti, 2014; Kawamoto et al., 2014).
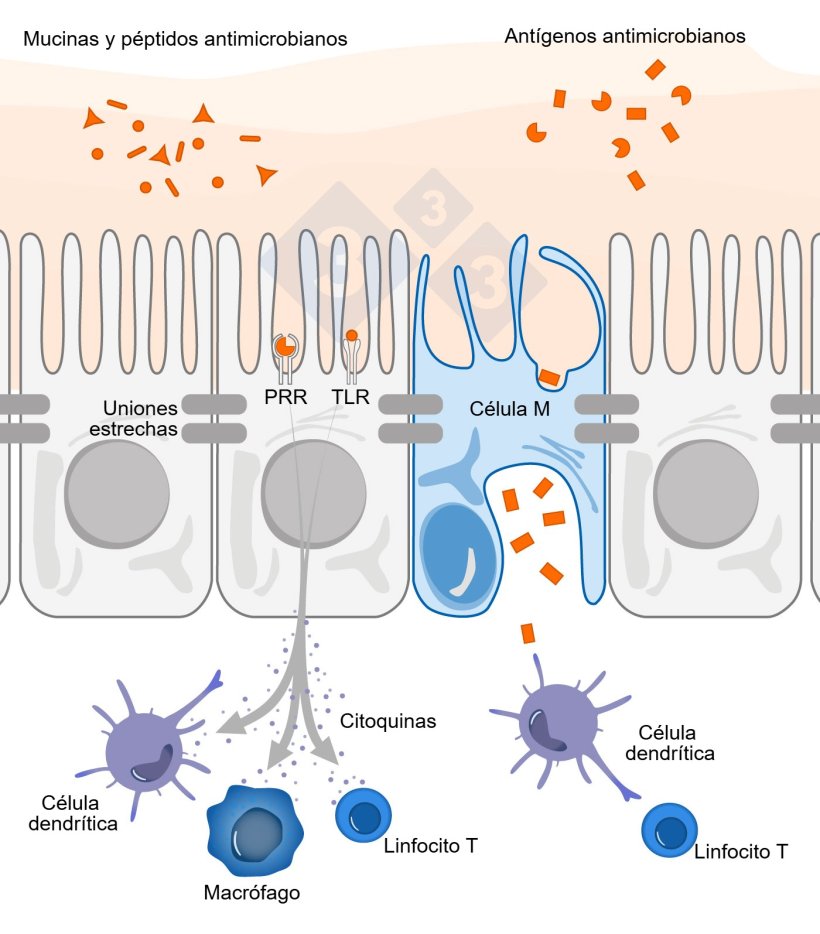
Figura 1. Diagrama esquemático que ilustra el mecanismo de acción de las células inmunitarias intestinales en respuesta a amenazas externas.
Conclusión
La inmunidad intestinal es un sistema complejo, formado por barreras físicas, células inmunitarias, receptores y microbiota. Cuando está en equilibrio, protege frente a patógenos y contribuye al rendimiento productivo de los cerdos. Sin embargo, factores como el estrés, el destete precoz o las infecciones pueden comprometer esta defensa, provocando inflamación y pérdidas de producción. Comprender la complejidad de la inmunidad intestinal y buscar estrategias para preservarla es esencial para una producción porcina eficiente, rentable y sostenible.



