Se aborda este capítulo desde la perspectiva de que la farmacovigilancia no afecta y obliga únicamente al laboratorio, sino a todos los agentes que intervienen en la administración del medicamento y tienen conocimiento de una reacción adversa del mismo.
La legislación española referente a la Farmacovigilancia Veterinaria viene recogida en el Capítulo IX del Real Decreto 1246/2008 por el que se regula el procedimiento de autorización, registro y farmacovigilancia de los medicamentos veterinarios. En este decreto se considera a los profesionales sanitarios (veterinarios) como agentes del Sistema Español de Farmacovigilancia de medicamentos veterinarios, sujetos a las obligaciones que se recogen en este artículo.

Podríamos definir la farmacovigilancia como el conjunto de actividades encaminadas a conocer y evaluar de manera continuada la EFICACIA y la SEGURIDAD de los medicamentos veterinarios.
 Su objetivo es identificar en los medicamentos comercializados, las propiedades no deseadas que no pudieron observarse durante los estudios de desarrollo del producto, ya que si bien suele hacerse toda una batería de ensayos y estudios conducentes a garantizar la calidad, seguridad y eficacia de los medicamentos veterinarios que someten a registro, no es posible contar con un conocimiento completo del comportamiento de los mismos una vez éstos se administran en condiciones reales, en las que podemos incluir: especies de destino no autorizadas, diferentes razas de cada especie, diversas condiciones de manejo de las explotaciones, la administración en animales con diferentes patologías concomitantes o que reciben tratamientos con más de un medicamento, circunstancia bastante común en el ámbito veterinario.
Su objetivo es identificar en los medicamentos comercializados, las propiedades no deseadas que no pudieron observarse durante los estudios de desarrollo del producto, ya que si bien suele hacerse toda una batería de ensayos y estudios conducentes a garantizar la calidad, seguridad y eficacia de los medicamentos veterinarios que someten a registro, no es posible contar con un conocimiento completo del comportamiento de los mismos una vez éstos se administran en condiciones reales, en las que podemos incluir: especies de destino no autorizadas, diferentes razas de cada especie, diversas condiciones de manejo de las explotaciones, la administración en animales con diferentes patologías concomitantes o que reciben tratamientos con más de un medicamento, circunstancia bastante común en el ámbito veterinario.
Esta vigilancia incluye, además de los acontecimientos adversos ocurridos en animales, aquellos que tengan lugar en seres humanos, la falta de eficacia esperada, la superación de los límites de residuos, el uso en condiciones no aprobadas (observaciones adversas relacionadas con cualquier uso no mencionado en la ficha técnica) y los efectos potenciales sobre el medio ambiente.
Los diferentes agentes que intervienen en la farmacovigilancia veterinaria son:
- El notificante. Suele ser el propietario de los animales o el veterinario responsable de los mismos.
- La Persona Cualificada: Es la persona designada por el titular de la autorización de comercialización del medicamento para recopilar todos los datos relevantes e informar a las Autoridades competentes.
- Las Autoridades competentes: evalúan los informes recibidos, son responsables de realizar un análisis riesgo/beneficio y si es necesario, de tomar las medidas de gestión apropiadas.
Se consideran dos tipos de acontecimientos o reacciones adversas según su gravedad:
- Acontecimiento adverso: reacción perjudicial y no intencionada y que ocurre con dosis utilizadas normalmente en los animales para la prevención, el diagnóstico o el tratamiento de enfermedades o para la modificación de funciones fisiológicas.
- Acontecimiento adverso grave: cualquier acontecimiento adverso que ocasione la muerte, pueda poner en peligro la vida, ocasione una discapacidad o invalidez significativa o constituya una anomalía congénita o defecto de nacimiento, u ocasione síntomas permanentes o prolongados en los animales tratados.
Obligaciones del personal sanitario
Los propietarios y más especialmente los veterinarios responsables del tratamiento de los animales también deben cumplir una serie de obligaciones en el sistema de farmacovigilancia:
- Colaborar con la AEMPS y con los responsables de farmacovigilancia del titular.
- Notificar cualquier acontecimiento adverso del que tenga conocimiento durante su práctica habitual aunque no sea grave a la AEMPS o al titular.
- Conservar documentación clínica de los acontecimientos adversos.
La notificación se lleva a cabo mediante un formulario específico o “tarjeta verde”, que está diseñado para su envío por correo postal prefranqueado o electrónicamente a través de VIGÍA-VET.
La notificación de un acontecimiento adverso es sencilla y bastan 4 datos mínimos para llevarla a cabo:
- Persona que comunica
- Especie animal
- Reacción adversa
- Medicamento
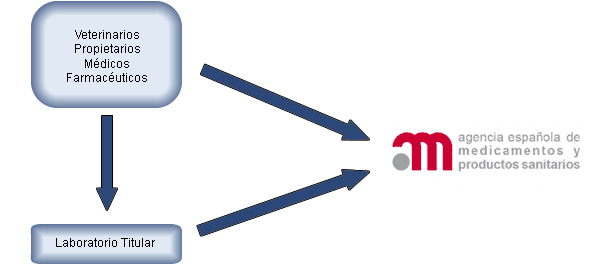
La notificación se puede remitir al titular de la autorización de comercialización o bien directamente a la AEMPS (ver el esquema). En caso de que se notifique al titular, éste remitirá posteriormente dicha notificación a la AEMPS.
Del boletín de farmacovigilancia del año 2011 publicado por la AEMPS se desprenden las siguientes conclusiones:
- Se recibieron 429 Sospechas de Efectos Adversos (SAEs), 77 (18%) comunicadas por profesionales sanitarios y 352 (82%) por los titulares de la autorización).
- El número de SAEs ocurridas en España notificadas durante 2011 sigue siendo bajo, estando aún lejos de los índices de otros países de nuestro entorno con poblaciones animales y número de tratamientos anuales parecidos a los nuestros, donde se superan las 3.000 SAEs cada año.
- El número de titulares que comunican Efectos Adeversos es todavía bajo (25) teniendo en cuenta el número de titulares que comercializaron medicamentos veterinarios en España.
En resumen, es necesaria una mayor concienciación por parte de todos los agentes para mejorar el control sobre los efectos adversos de los medicamentos veterinarios.



