Estrategias de inmunización frente al virus PRRS
Laura Garza. Ceva Salud Animal
El Síndrome Reproductor y Respiratorio Porcino (Porcine Reproductive and Respiratory Syndrom, PRRS) fue descrito por primera vez en los Estados Unidos a finales de los años 801,2. Desde entonces, el PRRS se considera una de las enfermedades más importantes en la producción porcina mundial debido a las cuantiosas pérdidas económicas que genera. En Europa, un estudio estimó que el coste de la enfermedad durante un brote oscilaría entre 59 y 379€ por cerda, mientras que en una situación endémica (tras el brote), los costes podrían oscilar entre 3 y 160 € por cerda3. Otro estudio más reciente realizado en Estados Unidos, reafirmó los elevados costes que supone esta enfermedad, estimándolos 114 dólares anuales por cerda4.
Dado el impacto económico que supone el PRRS para los países productores de porcino, durante todo este tiempo, se han desarrollado numerosas medidas de prevención y control frente a esta enfermedad, entre las que se incluye las medidas de bioseguridad externa/interna y la vacunación. El primer objetivo para controlar el PRRSV en las explotaciones es conseguir lechones negativos en el momento del destete. Para alcanzarlo, se debería estabilizar la circulación del virus en las reproductoras, limitando así la infección horizontal (contacto directo madre-lechón) como la vertical (infección transplacentaria del lechón)5.
En general, la inmunización mediante la vacunación es el método más sencillo y rápido para estabilizar los lotes de cerdas. Actualmente, se dispone de dos tipos de vacuna: vacunas atenuadas (modified lived vaccines, MLV) y vacunas inactivadas o muertas (killed vaccines, KV). Esta vacunación reduce la duración de la viremia cuando el animal vacunado se infecte y la excreción del virus, contribuyendo a limitar la transmisión entre animales y estabilizar la granja. No obstante, dada la enorme variabilidad del virus del PRRS y su capacidad inmunomoduladora6, ambos tipos de vacunas inducen una “protección parcial”. Este hecho ha sido demostrado en varios estudios en los que el grado de protección fue diferente en animales inmunizados y desafiados con cepas heterólogas (del mismo genotipo o distinto)7,8 u homólogas y muy próximas desde el punto de vista genético9. Esta protección incompleta implica que la eficacia de la vacuna estará condicionada por el manejo y la bioseguridad de la granja.
En la actualidad, la opinión generalizada es que ninguno de los protocolos vacunales existentes, basados en la utilización de una sola vacuna, ofrecen una protección eficaz y duradera. Por ello, se han desarrollado programas de vacunación mixtos basados en la sensibilización del sistema inmune con un tipo de vacuna y el refuerzo inmunitario mediante otro tipo de vacuna. Estos protocolos se han utilizado anteriormente en el control de otros patógenos como el virus de la fiebre aftosa (FMDV) en porcino10 y el virus diarrea vírica bovina (BVD)11 y el virus respiratorio y sincitial bovino (BRSV) en ganado bovino12.
En el caso del PRRS, el protocolo de vacunación mixta consiste en realizar una primera inmunización de los animales con una vacuna MLV y una revacunación con una KV. La primovacunación con MLV tiene como objetivo estimular el sistema inmune desarrollando inmunidad, mientras que la segunda vacunación con KV reforzará el sistema inmunitario sin introducir otro virus vivo en los animales. De este modo, se consigue un “efecto booster” evitando la posible reversión a virulencia del virus vacunal atenuado al replicarse en los animales. Este aspecto es importante en virus con altas tasas de mutaciones como es el virus del PRRS, ya que en cada ciclo de replicación se producen cambios en el genoma del virus que podrían aumentar su virulencia13.
El beneficio de los programas de vacunación mixta se ha demostrado en numerosas pruebas, tanto en condiciones experimentales como de campo. A nivel experimental, Diaz et al. (2013)14 evaluaron la eficacia de distintos protocolos de vacunación frente al desafío con una cepa del virus del PRRS perteneciente al genotipo 1. En este estudio, se utilizó la vacuna Progresiss® (Ceva) como KV y se realizaron dos experimentos diferentes: 1) Evaluación del efecto de las revacunaciones con KV sobre la respuesta humoral y celular y 2) Evaluación de la eficacia de distintas combinaciones vacunales (MLV+KV, MLV+MLV, MLV+KV+KV y un grupo control no vacunado). Los resultados obtenidos en el primer experimento demostraron que la vacunación con Progresiss® indujo un desarrollo de los anticuerpos neutralizantes (AN) tras el desafío más rápido que el grupo no vacunado y una elevada respuesta celular (IFN-γ) tras la segunda vacunación. Respecto al segundo experimento llevado a cabo en este estudio, los resultados mostraron que los protocolos MLV+KV y MLV+MLV indujeron títulos de AN similares, mientras que los animales del grupo MLV+KV+KV mostraron títulos de AN superiores que los dos grupos anteriores (Tabla 1). En conclusión, el protocolo en el cual se combinó una primovacunación con MLV con sucesivas vacunaciones con KV resultó inducir una respuesta inmunitaria mayor que el resto de protocolos evaluados.
Tabla 1. Proporción de lechones positivos a PRRS y título medio de
anticuerpos neutralizantes (log2) ± desviación estándar (SD) a diferentes tiempos (Díaz et al., 2013).
| Grupo | Edad en meses | Días post inoculación | |||
| 4,5 | 5,5 | 6,5 | 14 | ||
| MLV+KV | Lechones positivos | 1/8 | 2/8ab | 5/8 ab | 8/8 a |
| Título medio (log2) ±SD | 1,0±0,0 | 2,0±1,4 | 2,8±0,8 | 3,2±0,7 | |
| MLV+MLV | Lechones positivos | 0/8 | 4/8a | 5/8 a | 7/8 ab |
| Título medio (log2) ±SD | - | 1,5±1,0 | 1,6±0,9 | 2,1±1,3 | |
| MLV+KV+KV | Lechones positivos | 3/8 | 5/8a | 6/8 a | 8/8 a |
| Título medio (log2) ±SD | 1,0±0,0 | 1,4±0,5 | 2,2±1,6 | 3,6±1,2 a | |
| Control | Lechones positivos | 0/8 | 0/8b | 0/8b | 4/8 b |
| Título medio (log2) ±SD | - | - | - | 2,2±0,5 | |
Un valor de superíndice distinto en la misma columna indica diferencias estadísticamente significativas (P < 0,05) entre grupos para la proporción de lechones positivos o el título medio en un tiempo concreto.
En cuanto a los estudios realizados en condiciones de campo, los resultados obtenidos indican que la aplicación de vacunas KV, en granjas infectadas y en animales con inmunidad previa, proporciona una mejora de los parámetros productivos en las cerdas vacunadas15. Asimismo, Dekens et al. (2013)16 evaluó el efecto de la vacunación con una dosis adicional de Progressis® (el día 90 de gestación) sobre los títulos de anticuerpos maternales frente al PRRS en los lechones en una granja de ciclo cerrado con circulación de PRRS en transición. A su vez, se evaluó el impacto de estos anticuerpos maternales sobre la infección de los lechones durante el periodo de transición. Tras vacunación, los anticuerpos maternales fueron más elevados y duraderos, y no observó seroconversión en los lechones hasta, al menos, las 8 semanas de vida (Tabla 2). Estos resultados indican que la vacunación con Progressis® antes del parto (D90) puede inducir una inmunidad pasiva prolongada que reduciría la infección temprana de los lechones. Resultados similares se obtuvieron por Defoort et al. (2014)17 vacunando a las cerdas en gestación con MLV (D60) y Progressis® (D90). De forma similar, otra prueba18 evaluó la incorporación de Progressis® (D90) al plan vacunal de la explotación (primovacunación con MLV en cuarentena + MLV D60 gestación + MLV D6 lactación). Esta vacunación adicional supuso un aumento en el título de anticuerpos de los lechones de madres vacunadas, así como un retraso de la circulación del virus hasta la fase final de cebo (Figura 1).
Tabla 2. Resultados S/P ELISA frente al virus del PRRS en lechones antes y después de añadir la dosis adicional
de la vacuna Progressis® el D90 de gestación (Dekens et al., 2013).
| Edad de los lechones | 4 semanas | 7 semanas | 10 semanas |
| Antes – primer lote | 1,04 | 0,41 | 1,24 |
| Después – segundo lote | 1,79 | 1,07 | 0,57 |
| Después – tercer lote | 2,50 | 1,80 | 1,00 |
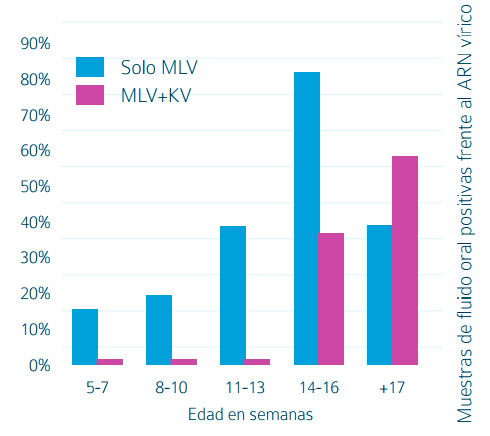
de los lechones en diferentes grupos de edad (Bolvent et al., 2016).
Además de los parámetros virológicos, en otro estudio19 se observó una mejora de los parámetros productivos tras sustituir el plan vacunal de las reproductoras por el combinado (MLV- D60 y Progressis®- D90). De este modo, el número de nacidos vivos, el número de lechones destetados y la ganancia media diaria de éstos aumentó, mientras que la mortalidad post-destete descendió.
En conclusión, los estudios realizados en condiciones experimentales y en campo, demuestran que los programas vacunales mixtos (MLV + KV) pueden ser una herramienta eficiente para estabilizar la circulación de PRRS en las explotaciones. A su vez, confirman que una dosis adicional de vacuna inactivada a final de gestación (D90), tras una estimulación previa con MLV, mejora la respuesta del sistema inmunitario de las reproductoras. Esto se traduce en una mejora de los parámetros productivos y en una inmunidad pasiva de los lechones que podría controlar las infecciones tempranas y la circulación del virus post-destete.
REFERENCIAS BIBLIOGRÁFICAS
1. Keffaber, KK. (1989). Am.Assoc.Swine Pract. Newsl. 1, 1-10. Reproductive failure of unknown etiology.
2. Wensvoort, G., et al. (1991). Vet. Q. 13, 121-130. Mystery swine disease in the Netherlands: the isolation of Lelystad virus.
3. Nieuwenhuis N, et al. (2012). Vet Rec. ;170(9):225. Economic analysis of outbreaks of porcine reproductive and respiratory syndrome virus in nine sow herds.
4. Holtkamp DJ, et al. (2013). J Swine Health Prod.;21(2):72-84. Assesment of the economic impact of porcine reproductive and respiratory syndrome virus on United States pork producers.
5. Corzo CA, et al. (2010). Virus Res. ;154(1-2):185-92. Control and elimination of porcine reproductive and respiratory syndrome virus.
6. Lee, C., et al. (2004). Vet. Immunol. Immunopathol. 102, 189-198. Differential host cell gene expression regulated by the porcine reproductive and respiratory syndrome virus GP4 and GP5 glycoproteins.
7. Labarque, G., et al. (2004). Vaccine 22, 4183-4190. Impact of genetic diversity of European-type porcine reproductive and respiratory syndrome virus strain on vaccine efficacy.
8. Labarque, GG., et al. (2003). Vet. Microbiol. 95, 187-197. Respiratory tract protection upon challenge of pigs vaccinated with attenuated porcine reproductive and respiratory syndrome virus vaccines.
9. Prieto, C., et al. (2008). Vet. J. 175, 356-63. Similarity of European porcine reproductive and respiratory syndrome virus strains to vaccine strain is not necessarily predictive of the degree of protective immunity conferred.
10. Li, Y., et al. (2008). Vaccine. 26 (21): 2647-2656. Dramatic improvement in FMD DNA vaccine efficacy and crossserotype antibody induction in pigs following a protein boost.
11. Reber, A. J., et al. (2006). Comparative Immunology, Microbiology & Infectious Diseases 29: 61-77. Evaluation of multiple immune parameters after vaccination with modified live or killed bovine viral diarrhea virus vaccines.
12. Letellier, C., et al. (2008). Vaccine. 26 (37): 4840-4848. Vaccination of calves using the BRSV nucleocapsid protein in a DNA prime-protein boost strategy stimulates cell-mediated immunity and protects the lungs against BRSV replication and pathology.
13. Karniychuk, UU., et al. (2009). Placenta 30, 497-500. Quantitative changes of sialoadhesin and CD163 positive macrophages in the implantation sites and organs of porcine embryos/fetuses during gestation.
14. Díaz, I., et al. (2013). Vet J. 197(2):438-44. Comparison of different vaccination schedules for sustaining the immune response against porcine reproductive and respiratory syndrome virus.
15. Gass-Cofre, A., et al. (2004). Proc. of the 18th International Pig Veterinary Society Congress, Hamburg, Germany, p. 120. The safety and efficacy of a simultaneous PRRS (Progressis®) and PPV/Erysipelas (Parvoruvac®) vaccination in endemically PRRSV infected breeding herds.
16. Dekens, V., et al. (2013). Proc. 5th ESPHM. p190. Induction of maternal immunity by vaccination of sows at end of gestation with PROGRESSIS®.
17. Defoort, P., et al. (2014). Proc. 23rd IPVS Cong. p565. Stabilization of PRRSV circulation in a farm using a vaccination program with PROGRESSIS® at the end of gestation.
18. Boivent, B., et al. (2016). 24th IPVS/8th ESPHM cong., Dublin, Rep. of Ireland. PRRS Dual Technology mix vaccination program (MLV/ KV): virus circulation monitoring in pig flows using oral fluids.
19. Spaans, J., et al. (2016). 24th IPVS/8th ESPHM cong., Dublin, Rep. of Ireland. Effect of Dual Technology Prime Boost (DTPB) vaccination in sows on circulation of PRRSV in post-weaning piglets.
Contacto:
Contacta con nosotros a través del siguiente formulario.