Forceris


COCCIDIOSIS
Causa de grandes pérdidas económicas en porcino1
Impacto de la coccidiosis sobre la producción

LA PREVENCIÓN TEMPRANA ES CLAVE
Cuanto más temprana es la infección de los lechones, mayor es el impacto de la enfermedad2
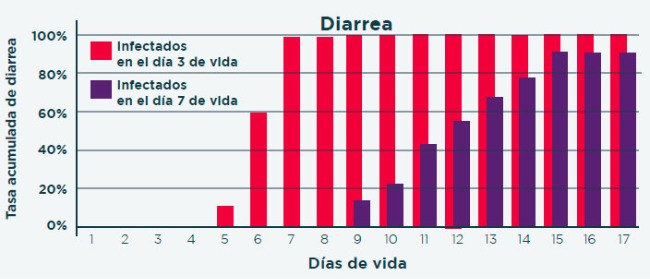
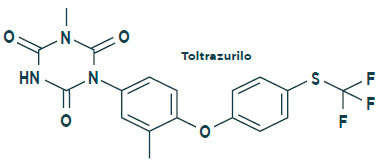
El TOLTRAZURILO ha demostrado ser una molécula eficaz frente a la coccidiosis
ANEMIA FERROPÉNICA
Deficiencia más frecuente en lechones neonatos3

La deficiencia de hierro debe contrarrestarse mediante la suplementación4
La suplementación de hierro debe cumplir 2 criterios
- Aportar una cantidad suficiente de hierro para la eritropoyesis
- Evitar la anemia y asegurar el correcto crecimiento de los animales
FORCERIS™
Un nuevo concepto en la prevención y el manejo del lechón
FORCERIS™, la primera combinación inyectable de Toltrazurilo y Gleptoferrón.

Los primeros días de vida del lechón son un período crítico para su manejo y salud. FORCERIS™ facilita el trabajo y mejora la salud del lechón


1. Mundt, Journal of Animal Protozooses, 2005. 2. Mundt et al., Parasitology Research, 2003. 3. Egeli et al., Acta Veterinaria Scandinavica, 1998. 4. Salle et al., Proceeding of the 19th IPVS Congress, 2006.
FORCERIS™ 30 mg/ml + 133 mg/ml. Suspensión inyectable para lechones. Composición: cada ml contiene: sustancias activas: toltrazurilo 30,0 mg, hierro (III) 133,4 mg, (como gleptoferron 355,2 mg). Excipientes: fenol 6,4 mg. Especies de destino: porcino (lechones 24 a 96 horas después del nacimiento). Indicaciones de uso: para la prevención simultánea de la anemia por deficiencia de hierro y la prevención de los signos clínicos de la coccidiosis (diarrea) así como la reducción de la excreción de ooquistes en lechones en granjas con antecedentes confirmados de coccidiosis causada por Cystoisospora suis. Contraindicaciones: no usar en lechones de los que se sospecha sufren una deficiencia de vitamina e y/o selenio. Advertencias especiales: como con otros parasiticidas, el uso frecuente y repetido de antiprotozoarios de la misma clase puede conllevar el desarrollo de resistencias. Se recomienda administrar a todos los lechones de cada camada. Una vez que los signos clínicos de coccidiosis sean evidentes, ya se habrá producido un daño en el intestino delgado. Por lo tanto, el producto debe administrarse a todos los animales antes del inicio esperado de los signos clínicos, es decir, en el período de prepatencia. Las medidas higiénicas pueden reducir el riesgo de coccidiosis porcina. Por ello, se recomienda mejorar simultáneamente las condiciones higiénicas en las instalaciones, especialmente la sequedad y la limpieza. El medicamento está recomendado en lechones que pesen entre 0,9 y 3 kg. Precauciones especiales: no debe excederse la dosis recomendada, dado el relativamente bajo margen de seguridad para el medicamento veterinario. El medicamento no debe administrarse más de una vez. No se recomienda usar el medicamento veterinario en lechones que pesen menos de 0,9 kg. Únicamente use este medicamento veterinario en granjas con antecedentes de Cystoisospora suis confirmados. El veterinario responsable debe tener en cuenta los resultados de los exámenes clínicos y/o analíticos de muestras fecales y/o en los hallazgos histológicos que confirmaron la presencia de C. suis en episodios anteriores de infección en la granja. Las personas con hipersensibilidad conocida al hierro (como complejo gleptoferrón), al toltrazurilo o a cualquiera de los excipientes deben evitar todo contacto con el medicamento veterinario. La exposición al medicamento veterinario puede causar irritación en ojos o efectos adversos en la piel. Evite el contacto de la piel y los ojos con el producto. En caso de exposición accidental en piel u ojos, lave el área afectada con agua. La autoinyección accidental puede causar reacciones locales como irritación, granulomas o reacciones anafilácticas graves en personas sensibles. Se debe tener cuidado para evitar la autoinyección accidental. En caso de autoinyección accidental, consulte con un médico inmediatamente y muéstrele el prospecto o la etiqueta. Este medicamento puede ser perjudicial para el feto. Las mujeres embarazadas o que tengan intención de concebir, deben evitar el contacto con el medicamento veterinario, especialmente la autoinyección accidental. Lávese las manos después del uso. Reacciones adversas: se han observado muertes en lechones tras la administración parenteral de inyecciones de hierro en muy raras ocasiones. Estas muertes se han relacionado con factores genéticos o deficiencias en vitamina e y/o selenio. Se han notificado muertes de lechones que se han atribuido a una mayor susceptibilidad a la infección debido al bloqueo temporal del sistema reticuloendotelial. Pueden producirse reacciones de hipersensibilidad. Posología y vía de administración: vía intramuscular. Agitar bien (durante 20 segundos) antes de usar. La dosis recomendada es de 45 mg de toltrazurilo y 200 mg de hierro por lechón, equivalentes a 1,5 ml de Forceris™ por lechón, que se administrará una vez, en una única inyección intramuscular detrás de la oreja, entre 24 y 96 horas después del nacimiento). Tiempos de espera: carne: 70 días. Incompatibilidades principales: en ausencia de estudios de compatibilidad, este medicamento veterinario no debe mezclarse con otros medicamentos veterinarios. Período de validez: período de validez del medicamento veterinario acondicionado para su venta: 3 años. Período de validez después de abierto el envase primario: 28 días. Precauciones especiales de conservación: este medicamento veterinario no requiere condiciones especiales de conservación. Formatos: caja con 1 vial de 250 ml. Precauciones especiales para la eliminación del medicamento veterinario no utilizado o, en su caso, los residuos derivados de su uso: todo medicamento veterinario no utilizado o los residuos derivados del mismo deberán eliminarse de conformidad con las normativas locales. Titular de la autorización de comercialización: Ceva Santé Animale, 10 Av. De la Ballastière, 33500 Libourne, Francia. Número de la autorización de comercialización: EU/2/19/235/001–003.