Parvovirosis porcina: una actualización
André Felipe Streck, Aline de Barros Moyses, Jéssica Martins Tadeu y Tamiris Silva Lopes
Laboratório de Diag nóstico em Medicina Veterinária, Universidade de Caxias do Sul
Resumen
El parvovirus porcino (PPV) se considera como uno de los principales causantes de problemas reproductivos en la porcicultura. Entre los signos clínicos comúnmente asociados a la infección por PPV están muerte fetal, fetos momificados, nacimiento de mortinatos y retraso en el retorno al estro. El parvovirus porcino siempre se ha considerado como un virus conservado, sin la emergencia constante de nuevas variantes. Sin embargo, se ha sugerido que algunos parvovirus exhiben una tasa de sustitución cercana a algunos virus de ARN. En este contexto, se han reportado nuevos fenotipos de PPV durante los últimos años, pero su importancia clínica y su capacidad para reducir la eficacia de las vacunas siguen generando dudas. Esta revisión tiene por objeto presentar una visión general sobre la estructura, la patogenia y los aspectos clínicos del PPV, destacando el descubrimiento de nuevos perfiles de cápside y estudios sobre las vacunas utilizadas actualmente.
Parvovirosis porcina: una actualización
En producción porcina, los problemas reproductivos que afectan a los rebaños causan grandes pérdidas económicas. La parvovirosis es una de las enfermedades reproductivas más comunes que afectan a los cerdos y tiene como agente etiológico el parvovirus porcino (PPV), recientemente también denominado como Ungulate protoparvovirus 1 (Truyen y
Streck, 2012). Este virus fue obtenido por primera vez en Alemania en 1965 como un contaminante de un cultivo de células primarias porcinas que se utilizó para la propagación del virus de la peste porcina clásica (Streck et al., 2015); desde su descubrimiento, el PPV se mantiene como un problema mundial constante en ese sector industrial (Mészáros et al., 2017). Esta virosis es responsable de problemas reproductivos en las hembras, que afectan principalmente a las nulíparas. Estos trastornos se pueden resumir con las siglas SMEDI (mortinato, momificación, muerte embrionaria e infertilidad) (Streck et al., 2015). En la actualidad, se ha identificado tan un solo serotipo. Sin embargo, ya se han reportado diferencias de patogenicidad entre cepas de campo, existiendo cepas patógenas y no patogénicas (Truyen y Streck, 2012).
ETIOPATOGENIA
El PPV es un virus de gran estabilidad e infectividad, factores que facilitan la diseminación de la infección y que conllevan su difusión en gran parte de la población porcina. El parvovirus puede ser introducido en los rebaños a través de reproductores infectados, pudiendo haber transmisión del virus por el semen contaminado. Además del semen, la transmisión también puede ocurrir por el contacto oronasal con animales infectados o con sus secreciones y excreciones, como heces o restos fetales (Gradil et al., 1990; Streck et al., 2013). Después de infectar al animal, el PPV se replica en los tejidos linfoides, glándulas salivales, pulmones, médula ósea y criptas intestinales (Duhamel et al., 1991). Debido a la replicación en las células intestinales se puede producir contaminación ambiental, lo que puede causar una diseminación rápida (Carter y Saunders, 2013). En el ambiente infectado, las concentraciones más elevadas de PPV se encuentran en las salas de parideras, pues el virus presenta tropismo por los tejidos del embrión y/o del feto y envolturas fetales (Truyen y Streck, 2012). Las hembras nulíparas pueden estar protegidas por la presencia de anticuerpos maternos hasta un máximo de seis meses de vida; posteriormente, desaparece la protección pasiva y las cerdas inician el ciclo reproductivo (Truyen y Streck, 2012). Si no son inmunes al virus, es decir, si no están vacunadas o si han sido vacunadas de forma incorrecta, se encuentran sin inmunidad activa para el PPV, son más susceptibles a la infección y, en consecuencia, presentan una mayor probabilidad de padecer trastornos reproductivos (Carter y Saunders, 2013).
¿Cómo evoluciona la infección?
La transmisión vertical al feto tarda entre 12 y 18 días después de la infección inicial de las madres por la vía natural (oral) (Joo et al., 1976, Mengeling et al., 1980), debido a la capacidad del virus para causar infección transplacentaria. La evolución de la infección depende de la etapa de la gestación en la que se encuentra la hembra (figura 1).
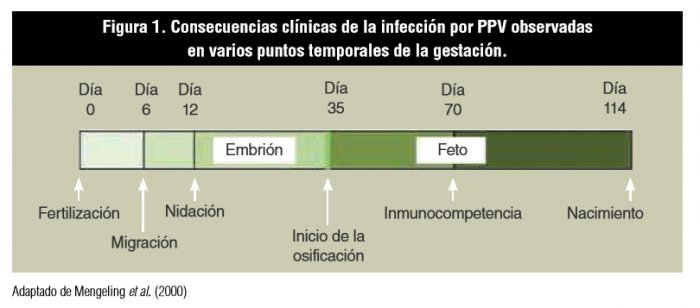 En la fase embrionaria, hasta los 30 días de gestación, la infección generalmente lleva a la muerte y reabsorción de los embriones. Si se produce la muerte de la mayoría de los embriones, la hembra puede volver a salir en celo con un intervalo regular o irregular; por el contrario, si la mayoría de los embriones resiste, la camada que nazca será pequeña, ya que los embriones muertos son reabsorbidos (Mengeling, 1979). A partir del día 35 de gestación, se inicia la fase fetal y la osificación, con deposición de calcio en los huesos fetales, que impide la reabsorción de los fetos. Cuando la infección fetal ocurre entre los 30 y 70 días de gestación, es común que se produzca muerte y momificación fetal. En general, cuando esto sucede veremos que la cerda pare una camada compuesta de lechones sanos y momificados (Truyen y Streck, 2012). Los fetos inmunocompetentes infectados después de 70 días de gestación desarrollan una respuesta de anticuerpos y generalmente sobreviven a la infección. El virus se elimina y los anticuerpos ya se pueden detectar en el suero del neonato (Truyen y Streck, 2012, Streck et al., 2015). Una posibilidad para explicar la baja infectividad del PPV en fetos en el último tercio de la gestación sería la disminución del proceso de mitosis, un hecho que perjudicaría a la replicación del virus (Mengeling et al., 2000).
En la fase embrionaria, hasta los 30 días de gestación, la infección generalmente lleva a la muerte y reabsorción de los embriones. Si se produce la muerte de la mayoría de los embriones, la hembra puede volver a salir en celo con un intervalo regular o irregular; por el contrario, si la mayoría de los embriones resiste, la camada que nazca será pequeña, ya que los embriones muertos son reabsorbidos (Mengeling, 1979). A partir del día 35 de gestación, se inicia la fase fetal y la osificación, con deposición de calcio en los huesos fetales, que impide la reabsorción de los fetos. Cuando la infección fetal ocurre entre los 30 y 70 días de gestación, es común que se produzca muerte y momificación fetal. En general, cuando esto sucede veremos que la cerda pare una camada compuesta de lechones sanos y momificados (Truyen y Streck, 2012). Los fetos inmunocompetentes infectados después de 70 días de gestación desarrollan una respuesta de anticuerpos y generalmente sobreviven a la infección. El virus se elimina y los anticuerpos ya se pueden detectar en el suero del neonato (Truyen y Streck, 2012, Streck et al., 2015). Una posibilidad para explicar la baja infectividad del PPV en fetos en el último tercio de la gestación sería la disminución del proceso de mitosis, un hecho que perjudicaría a la replicación del virus (Mengeling et al., 2000).
MANIFESTACIONES CLÍNICAS
Mayoritariamente, la infección por PPV es asintomática en animales adultos. En la mayoría de los casos, la única evidencia es la insuficiencia reproductiva que se manifiesta como repeticiones, hembras vacías, muerte embrionaria seguida de reabsorción, fetos momificados, menor número de lechones nacidos, lechones pequeños y débiles y mortalidad neonatal (Mengeling et al., 2000). Las pérdidas reproductivas suelen ser bajas en los rebaños vacunados, pero el PPV puede causar una tormenta de abortos (gran número de abortos en un corto periodo) en rebaños no vacunados o en situaciones en las cuales la vacuna haya sido administrada incorrectamente (Brown et al., 1980, Dea et al., 1985, Duhamel et al. 1991). Los problemas reproductivos se observan principalmente en hembras nulíparas (Mengeling et al., 1975, Mengeling et al., 1979). En las hembras multíparas que tuvieron contacto previo con el agente, la acción del virus pasa a ser reducida o nula (Truyen y Streck, 2012). En machos la infección es asintomática y la calidad espermática y la libido no se ven afectadas (Christianson, 1992).
LESIONES
En los fetos normalmente se observa momificación. Las lesiones macroscópicas incluyen un grado variable de enanismo antes de que otros cambios externos sean evidentes (figura 2). Ocasionalmente, los vasos sanguíneos de la superficie del cuerpo se vuelven prominentes debido a la congestión y la filtración de sangre a los tejidos conectivos. 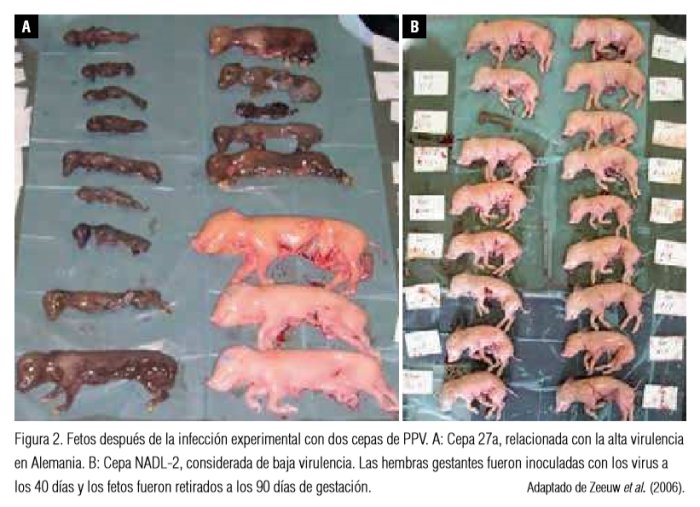
Congestión, edema, hidropericardio con hipertrofia de hasta dos ventrículos, hemorragia cerebral, congestión y necrosis hepática, hiperemia y hemorragia renal, hemorragia con acumulación de fluidos serosanguinolentos en las cavidades del cuerpo, decoloración hemorrágica que se vuelve progresivamente más oscura después de la muerte y deshidratación (momificación) son típicos de la infección por el PPV. La placenta puede estar deshidratada y marrón (Wilhelm et al., 2006). Como durante la infección intrauterina el virus se transmite de un feto a otro, la infección de la camada no ocurre simultáneamente; este hecho explica la presencia de fetos momificados en distintas fases de desarrollo fetal, muchas veces junto con fetos normales (Truyen y Streck, 2012). Las lesiones microscópicas en el feto tienden a ser generalizadas y principalmente representan necrosis de las células en los sistemas de órganos en desarrollo (Lenghaus et al., 1978). En los tejidos subcutáneos y masas musculares hay presencia de hemorragias. En los pulmones, los riñones y el músculo esquelético son comunes la necrosis y la mineralización, que pueden ser particularmente extensas en hígado y corazón (Lenghaus et al., 1978). Si la infección sucede cuando los fetos son inmunocompetentes, las lesiones microscópicas son hipertrofia del endometrio e infiltración de células mononucleares principalmente (Hogg et al., 1977). En las hembras no se observan lesiones macroscópicas, pero microscópicamente es posible observar un infiltrado inflamatorio mononuclear en las membranas placentarias y en el epitelio uterino, así como presencia de linfocitos en el sistema nervioso central y médula (Truyen y Streck, 2012).
VARIACIONES GENÉTICAS DE PPV
Hasta el inicio de los años 2000 no se estudiaron las variaciones genéticas de PPV, ya que se creía que era un virus muy estable porque las vacunas desarrolladas a partir de cepas antiguas conferían inmunidad contra sus variantes (Truyen y Streck, 2012). En los últimos 20 años, con el descubrimiento de nuevos perfiles de cápside de PPV, se pasó a estudiar su variabilidad genética. En general, se creía que los virus con genomas compuestos por ADN no poseían gran variabilidad, de modo que su estudio no era un área de importancia en el control y prevención de las enfermedades ocasionadas por el PPV (Lopez-Bueno et al., 2006). Esta idea fue inicialmente construida porque estos utilizan el complejo de polimerasa celular del huésped, capaz de mantener una gran fidelidad debido a un mecanismo de reparación de errores (Drake, 1991). En cambio, los virus con genoma compuesto por ARN, que no poseen sistemas de reparación de errores, presentan tasas de mutación mayores (Lopez-Bueno et al., 2006). Nuevos estudios revelaron la existencia de factores adicionales, como oxidación, metilación de bases y desaminación, que pueden afectar a las tasas de mutación, incluso en virus de ADN (Duffy et al., 2008).
Surgimiento de nuevas variantes virales
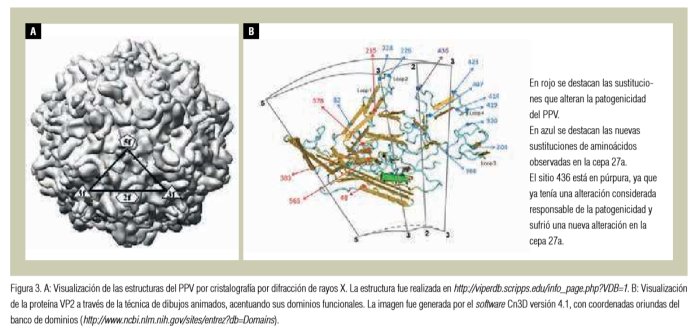
El primer estudio centrado en la variabilidad genética de las cepas de campo de PPV obtenidas entre 1994 a 2003 en Brasil se publicó en 2003 (Soares et al., 2003). En este estudio, se identificaron 18 perfiles de cápside diferentes y se observaron dos grupos filogenéticos. Posteriormente, otro estudio analizó muestras aisladas en 2001 y 2002 de Alemania y describió seis perfiles de cápside diferentes en otros dos grupos filogenéticos (Zimmermann et al., 2006). Después de estos estudios, se publicaron otros que relataron eventos clínicos en otros países, entre los que se incluyen Austria, China, Rumania y Suiza (Shangjin et al., 2009; Cadar et al., 2011; Hao et al., 2011; Streck et al., 2011, Streck et al., 2013). En estos trabajos la mayor prevalencia de cepas obtenidas en los cerdos domésticos estuvo relacionada con la cepa 27a. Recientemente, al analizar los perfiles de cápside viral encontrados en cerdos domésticos, se ha podido observar que las sustituciones de aminoácidos están localizadas principalmente en regiones conocidas como loops (figura 3) (Truyen y Streck, 2012). Una vez que los loops se localizan en la superficie de la cápside, estas sustituciones de aminoácidos pueden influir en la unión al receptor y/o la capacidad antigénica.
Los anticuerpos neutralizantes desempeñan un papel importante en la protección contra la infección por parvovirus, y ya se ha demostrado la reducción de su actividad de protección contra la cepa predominante (27a) en las infecciones de carácter experimental (Zeeuw et al., 2007; Foerster et al., 2016). Estos resultados conducen a la hipótesis de que la aparición de nuevas sustituciones de aminoácidos puede ocurrir debido a una adaptación viral a las vacunas utilizadas, y por lo tanto pueden representar “mutantes de escape” en una población parcialmente inmune. Esta posibilidad fue estudiada a través de la dinámica de la población viral, donde un modelo in vitro fue proyectado para reproducir una posible selección inmune (Streck et al., 2013). Se observó una reducción moderada y continua de la diversidad genética a partir de 1985. En otras palabras, el uso mundial de las vacunas contra el PPV probablemente no haya creado varios “mutantes de escape”, sino una reducción en la diversidad genética. Este fenómeno puede ser evidenciado cuando exista un agente que reduzca o dificulte la transmisión de un virus (Van Ballegooijen et al., 2009), y por lo tanto exista un predominio de algunas cepas; entre ellas, destaca la cepa 27a (Streck et al., 2013).
CONTROL DEL VIRUS
El PPV es un virus bastante presente en los cerdos y muy resistente en el medio ambiente, lo que dificulta su control y prevención en las granjas (Truyen y Streck, 2012). Por este motivo, y hasta el momento, la vacunación constituye el método más utilizado como control de la PPV, teniendo como principal objetivo estimular la inmunidad del animal para evitar infección intrauterina de los embriones o fetos (Días, 2010).
Vacunación
Las vacunas actualmente disponibles en el mercado poseen cepas aisladas desde hace 40 años, basadas en la NADL-2, que son efectivas contra infecciones homólogas. Sin embargo, no previenen la infección ni eliminan el virus después de ser expuestas al desafío con la cepa antigénicamente heteróloga. Estas vacunas se elaboran con el virus inactivado (en su mayoría con cepas similares a la cepa no virulenta NADL-2) (yen y Streck, 2012) y poseen un amplio margen de seguridad; además confieren protección contra el PPV aunque se administren en conjunto con otros agentes en vacunas polivalentes. El uso de estas vacunas induce buenos títulos de anticuerpos, suficientes para reducir las manifestaciones clínicas pero incapaces de prevenir la infección o diseminación (Jóźwik et al., 2009). Las vacunas de virus vivos modificadas (MLV) pueden ser una alternativa para el PPV. Se están desarrollando otras vacunas recombinantes con tecnologías más actuales, pero la inactivada sigue siendo la más utilizada debido a su amplio margen de seguridad (Truyen y Streck, 2012). El uso de MLV de parvovirus canino y del virus de la panleucopenia felina induce una respuesta inmunitaria de larga duración que protege al porcino durante varios años. Además, la ocurrencia y la distribución de nuevas variantes genéticas deben ser observadas con mucho cuidado. En un estudio, que aún no ha sido publicado, se ha observado que las nuevas mutaciones en las proteínas de la cápside pueden modificar las propiedades antigénicas, así como reducir la capacidad de unión y neutralización de los anticuerpos generados a partir de vacunas comerciales comúnmente utilizadas en porcino. Se ha comprobado también que los anticuerpos generados a partir de cepas predominantes (27a) poseen una capacidad superior de unión cruzada, con lo cual consiguen proteger de forma más eficiente a las poblaciones de cerdos.
BIBLIOGRAFÍA
- Brown TT, Paul Jr. PS y Mengeling WL.1980. Response of conventionally raised weanling pigs to experimental infection with a virulent strain of porcine parvovirus. American Journal of Veterinary Research, 41: 1221–1224.
- Cadar D, Dán Á, Tombácz K, Lőrincz M, Kiss T, Becskei Z, Spînu M, Tuboly T y Cságola A. 2012. Phylogeny and evolutionary genetics of porcine parvovirus in wild boars. Infection, Genetics and Evolution, 12: 1163-1171.
- Carter JB y Saunders VA. 2013. Parvoviruses (and Other ssDNA Viruses). Virology: Principles and Applications. 2. ed. West Sussex, Uk: Wiley. Cap. 12. p. 135-141.
- Christianson WT. 1992. Stillbirths, Mummies, Abortions and Early Embryonic Death. Veterinary Clinics of North America Food Animal Practice. Cap.8, p. 623-639.
- Dea S, Elazhary MASY, Martineau GP y Vaillancourt J. 1985. Diseases of swine. Canadian Journal of Comparative Medicine, 49:343–345.
- Duffy S, Shackelton L y Holmes EC. 2008. Rates of evolutionary change in viruses: patterns and determinants. Nature Review Genetics, 9:267-276.
- Duhamel GE, Bargar TW, Schmitt BJ, Molitor TW y LU W. 1991. Identification of parvovirus-like virus particles in intestinal crypt epithelial cells of pigs with diarrhea. Journal of Veterinary Diagnostic Investigation, 3:96-98.
- Foerster T, Streck AF, Speck S, Selbitz HJ, Lindner T y Truyen U. 2016. An inactivated whole-virus porcine parvovirus vaccine protects pigs against disease but does not prevent virus shedding even after homologous virus challenge. Journal of General Virology, 97:1-6.
- Gradil C, Molitor T, Harding M y Crabo B. 1990. Excretion of porcine parvovirus through the genital tract of boars. American Journal of Veterinary Research, 359-362.
- Hao X, Lu Z, Sun P, Fu UY, Cao Y, LI P, Bai X, Bao H, Xie B, Chen Y, Li D y Liu Z. 2011. Phylogenetic analysis of porcine parvoviruses from swine samples in China. Virology Journal, 8:320.
- Hogg GG, Lenghaus C y Forman AJ. 1977. Experimental porcine parvovirus infection of foetal pigs resulting in abortion, histological lesions and antibody formation. Journal of Comparative Pathology, 87: 539–549.
- Joo H, Donaldson-Wood C y Johnson R. Observations on the pathogenesis of porcine parvovirus infection. 1976. Archives of Virology, 51:123-129.
- Jóźwik A, Manteufel J, Selbitz HJ y Truyen U. 2009. Vaccination against porcine parvovirus protects against disease, but does not prevent infection and virus shedding after challenge infection with a heterologous virus strain. Journal of General Virology, 2437-2441.
- Lenghaus C, Forman AJ y Hale CJ. 1978. Experimental infection of 35, 50 and 60 day old pig foetuses with porcine parvovirus. Australian Veterinary Journal, 418.
- Lopez-Bueno A, Villarreal LP y Almendral JM. 2006. Parvovirus variation for disease: a difference with RNA viruses. Current Topics in Microbiology and Immunology, 299:349–370.
- Mengeling WL. 1979. Prenatal infection following maternal exposure to porcine parvovirus on either the seventh or fourteenth day of gestation. Canadian Journal of Comparative Medicine, 106. Mengeling WL,
- Paul PS y Brown TT. 1980. Transplacental infection and embryonic death following maternal exposure to porcine parvovirus near the time of conception. Archives of Virology, 65:55-62.
- Mengeling WL, Lager KM y Vordwald AC. 2000. The effect of porcine parvovirus and porcine reproductive and respiratory syndrome virus on porcine reproductive performance. Animal Reproduction Science, 199–210.
- Mészáros I, Olasz F, Cságola A, Tijssen P y Zádori Z. 2017. Biology of Porcine Parvovirus (Ungulate parvovirus 1). Viruses, 9: 393.
- Shangjin C, Cortey M y Segalés J. 2009. Phylogeny and evolution of the NS1 and VP1/VP2 gene sequences from porcine parvovirus. Virus Research, 209–215.
- Soares RM, Cortez A, Heinemann MB, Sakamoto SM, Martins VG, Bacci M, De Campos FM y Richtzenhain LJ. 2003. Genetic variability of porcine parvovirus isolates revealed by analysis of partial sequences of the structural coding gene VP2. Journal of General Virology, 1505-1515.
- Streck AF, Bonatto SL, Homeier T, Souza CK, Gonçalves KR, Gava D, Canal CW y Truyen U. 2011. High rate of viral evolution in the capsid protein of porcine parvovirus. Journal of General Virology, 92:2628-2636.
- Streck AF, Homeier T, Foerster T, Fischer S y Truyen U. 2013. Analysis of porcine parvoviruses in tonsils and hearts from healthy pigs reveals high prevalence and genetic diversity in Germany. Archives of Virology, 158:1173-1780.
- Streck AF, Canal CW y Uwe T. 2015. Molecular epidemiology and evolution of porcine parvoviruses. Infection, Genetics And Evolution, 36:300-306.
- Truyen U y Streck AF. 2012. Porcine Parvovirus. In: Zimmerman, Jeffrey J. et al. Diseases of Swine. 10. ed. Uk: Wiley-blackwell. Cap. 29. p. 447-454.
- Van Ballegooijen WM, Van Houdt R, Bruisten SM, Boot HJ, Coutinho RA y Wallinga J. 2009. Molecular sequence data of hepatitis B virus and genetic diversity after vaccination. American Journal of Epidemiology, 170:1455-1463.
- Wilhelm S, Zimmermann P, Selbitz HJ y Truyen U. 2006. Real-time PCR protocol for the detection of porcine parvovirus in field samples. Journal of Virological Methods, 134: 257-260.
- Wrathall AE, Wells DE, Cartwright SF y Frerichs GN. 1984. An Inactivated, Oil Emulsion Vaccine For The Prevention Of Porcine Parvovirus-Induced Reproductive Failure. Research In Veterinary Science, 36:136-143.
- Zeeuw EJL, Leinecker N, Herwig V, Selbitz HJ y Truyen U. 2007. Study Of The Virulence And Cross-Neutralization Capability Of Recent Porcine Parvovirus Field Isolates And Vaccine Viruses In Experimentally Infected Pregnant Gilts. Journal of General Virology, 88:420-427.
- Zimmermann P, Ritzmann M, Selbitz HJ, Heinritzi K y Truyen U. 2006. VP1 Sequences Of German Porcine Parvovirus Isolates Define Two Genetic Lineages. Journal of General Virology, 87:295-301.
Contacto:
Contacta con nosotros a través del siguiente formulario.