Datos experimentales y de campo han demostrado que el PRRSV se puede transmitir a través del semen. Durante la pasada década, la inseminación artificial se convirtió en práctica habitual en la industria porcina moderna y, por esa razón, el semen contaminado es en la actualidad uno de los principales riesgos de introducción del PRRSV en las granjas con cerdas negativas. Aunque la mayoría de las granjas de verracos han conseguido un estatus negativo para PRRSV y gozan de buenas prácticas de bioseguridad e instalaciones, no son raros los brotes de PRRSV. Por ese motivo, es decisivo para una granja de verracos disponer de un buen protocolo de vigilancia con el fin de detectar la posible introducción de PRRSV tan pronto como sea posible.
Por lo tanto, hemos diseñado un estudio para comparar diferentes protocolos de vigilancia de PRRSV para granjas de verracos negativos. Se desarrolló un modelo de simulación por ordenador para recrear la dinámica de la infección del PRRSV después de producirse una introducción en una granja de verracos negativos. Con este modelo podemos calcular cuántos verracos resultan infectados en cualquier día después de la introducción (DPI) así como cuántos darían positivo en pruebas de PCR en suero y semen, o de ELISA en suero.
El funcionamiento de los protocolos de vigilancia utilizando tamaños de muestra, frecuencias de muestreo y pruebas diagnósticas diferentes, se evaluó en 4.000 repeticiones del modelo estocástico. Los protocolos de vigilancia se compararon determinando el tiempo transcurrido desde la introducción del PRRSV hasta su detección.
El modelo pronosticó una detección más rápida de la introducción del PRRSV en modelos que utilizan la prueba de PCR en suero, seguido de los modelos de PCR en semen y ELISA en suero (Fig. 1). No se observó una ventaja evidente por usar ELISA+PCR en suero en comparación con sólo PCR.
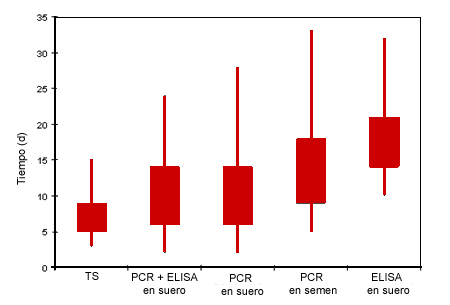 |
| Figura 1: Efecto de la técnica de diagnóstico / muestra en el tiempo transcurrido hasta la detección para protocolos que estudiaron 50 verracos a la semana. Los límites superior e inferior de los cuadros representan los percentiles 75 y 25 respectivamente. Los extremos superior e inferior de las líneas representan los percentiles 99 y 5 respectivamente. La distribución del tiempo transcurrido hasta el envío de semen contaminado (TS) se muestra como comparación. |
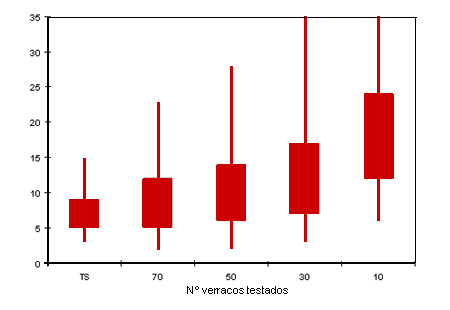 |
| Figura 2: Efecto del tamaño de la muestra en el tiempo transcurrido hasta la detección para protocolos que utilizan PCR en suero semanalmente. |
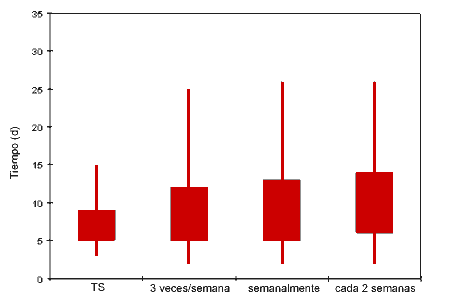 |
| Figura 3: Efecto de la frecuencia del muestreo en el tiempo transcurrido hasta la detección para protocolos que examinan un total de 240 sueros al mes por PCR. |
El modelo pronosticó un fuerte efecto del tamaño de la muestra en el tiempo transcurrido hasta la detección (Fig. 2). El aumento de la frecuencia de muestreo sin aumentar el número total de muestras procesadas por mes no pareció disminuir claramente el tiempo transcurrido hasta la detección. Por ejemplo, como se muestra en la figura 3, el tiempo transcurrido hasta la detección fue muy parecido para protocolos que procesaban un total de 240 muestras de suero por PCR al mes, ya fueran examinados 120 verracos cada 2 semanas, 60 verracos cada semana o 20 verracos cada lunes, miércoles y viernes. Esto se debe, aunque el aumento de la frecuencia permite vigilar la granja más a menudo, a que el tamaño de la muestra (y por lo tanto la potencia) de cada día de prueba es menor.
Las observaciones de campo sugieren que es necesario un protocolo de vigilancia intensivo para detectar una introducción del PRRSV con suficiente antelación para evitar el envío de semen contaminado a las granjas de cerdas. Los resultados del modelo de simulación confirmaron esta observación. Sólo los protocolos que utilizaron PCR y examinaron un gran número de muestras fueron capaces de detectar el PRRSV durante los 5 a 10 primeros días después de la introducción, que sería cuando se produciría el envío de semen contaminado en la mayoría de los casos.
En conclusión, el protocolo de vigilancia ideal para granjas de verracos negativos implicaría el análisis de un gran número de verracos mediante la prueba de PCR en suero. Como esto es caro y laborioso, los veterinarios utilizan estrategias alternativas para mejorar la rentabilidad de sus protocolos. Estas estrategias incluyen el uso de un hisopo sanguíneo en lugar de suero y la agrupación de muestras. El hisopo sanguíneo es una técnica descrita recientemente que, combinada con la prueba de PCR, ha mostrado niveles de sensibilidad semejantes a los de la prueba de PCR en suero. Esta técnica permite obtener con seguridad una muestra de sangre sin provocar estrés al verraco. El agrupar muestras es una estrategia que podría ser de utilidad si el metabolito a analizar estuviera presente en grandes cantidades en la muestra y la sensibilidad analítica de la prueba fuera elevada. Este puede ser el caso para PCR de muestras de suero de verracos durante las dos primeras semanas de infección. Sin embargo, la sensibilidad, tanto del hisopo sanguíneo por PCR como la agrupación de muestras de suero para PCR es menor por un efecto de dilución, en comparación con la sensibilidad de la prueba de PCR en suero en muestras individuales. Hasta la fecha es escasa la información para evaluar si estas dos estrategias deben utilizarse en los protocolos de vigilancia para granjas de verracos.




