Descripción del Senecavirus A
El Senecavirus A (SVA, antiguamente conocido como virus Seneca Valley) es un virus RNA sin envoltura de 30 nm. Es el único miembro del género Senecavirus, que pertenece a la familia Picornaviridae.

Aplicaciones del SVA e implicaciones patológicas
El SVA ha sido aislado en cerdos desde 1988 y se describió como tipo-picornavirus hasta 2002, cuando se aisló de un cultivo celular contaminado y fue llamado virus Seneca Valley (Reddy, Burroughs et al. 2007). De hecho, SVA ha sido identificado como virus no patogénico en humanos con propiedades oncolíticas y se está evaluando su eficacia como terapia contra el cáncer en ensayos clínicos con humanos (Rudin, Poirier et al. 2011). El genoma completo se secuenció en 2008 (Hales, Knowles et al. 2008).
Las investigaciones en el campo de la veterinaria sugieren que SVA circula entre los animales domésticos por lo menos desde finales de los años 80. Se han detectado anticuerpos frente a SVA en vacuno, ratones y cerdos (Knowles, Hales et al. 2006). También ha sido propuesto como agente causal de la enfermedad vesicular idiopática (IVD) en cerdos (Singh, Corner et al. 2012, Leme, Zotti et al. 2015). En resumen, la Organización Mundial de Sanidad Animal (OIE), y la mayoría de países, consideran de declaración obligatoria estas cuatro enfermedades vesiculares porcinas: la fiebre aftosa (Aphtovirus), la enfermedad vesicular porcina (Enterovirus), la estomatitis vesicular (Rhabdovirus) y exantema vesicular porcino (Calicivirus). Los casos de enfermedades vesiculares negativos a estos cuatro virus se consideran "enfermedad vesicular idiopática".
Pese a varios intentos, todavía no se ha podido reproducir experimentalmente la enfermedad vesicular a partir de SVA. Sin embargo, el virus ha sido demostrado mediante hibridación in situ en las lesiones vesiculares de los animales afectados (figura 1). Actualmente se está llevando a cabo un estudio para intentar reproducir la enfermedad vesicular con un SVA recién aislado en el medio-oeste de EE.UU., procedente de cerdos con enfermedad vesicular idiopática.
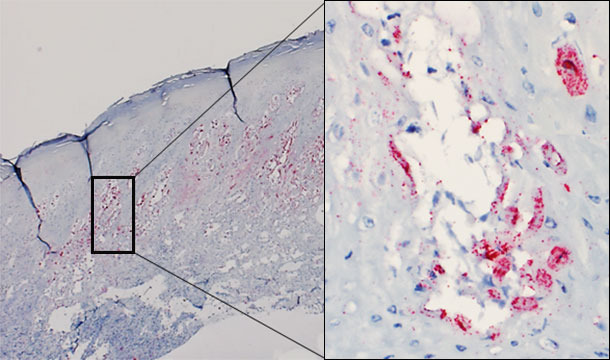
Figura 1 – Biopsia cutánea de una vesícula de un cerdo afectado. Se detecta la presencia de virus predominantemente en el estrato espinoso de la epidermis. Vesícula intraepidérmica: virus replicándose en los queratinocitos.
Asociación con ETNL, Brasil y EE.UU.
Recientemente (julio de 2015) Brasil ha informado de un nuevo síndrome asociado a SVA. El Dr. Vannucci, junto con otros colegas, han descrito un síndrome con pérdidas neonatales que afecta a lechones de 0-7 días de vida. La tasa de mortalidad es más elevada (40-80%) en lechones de 0-3 días y menor (20-40%) en los de 4-7 días. Las camadas de más de una semana no parecen estar clínicamente afectadas. Una vez se establece la enfermedad, empieza, relativamente rápido, un síndrome de desmedro que lleva a la muerte. La tasa de mortalidad normal se restablece en 4-10 días. Cabe destacar que la mayoría de lechones (>80%) tienen el estómago lleno de leche/calostro. Debido a estas características hemos propuesto el nombre de mortalidad neonatal epidémica transitoria (ETNL, por sus siglas en inglés)(Vannucci, Linhares et al. 2015) (figura 2).


Figura 2 - Características agudas y transitorias de la mortalidad neonatal epidémica transitoria (ETNL). Izquierda: aspecto típico de una camada afectada durante un brote de ETNL. Derecha: una nueva camada en la misma sala de partos 10 días después del brote de mortalidad.
El examen patológico de los lechones afectados de varias granjas de Brasil, y posteriormente del medio-oeste de EE.UU. no revelaron lesiones macroscópicas o histopatológicas comunes/consistentes que pudieran explicar la causa de la mortalidad. Un hallazgo consistente en las granjas con ETNL fue la detección de grandes cantidades de Senecavirus A en muchos tejidos de los lechones, incluyendo cerebro, sangre y tejidos linfoides, lo que indica una infección generalizada (Linhares, Rademacher et al. 2015) (figura 3). No se encontró SVA en tejidos de los lechones no afectados.
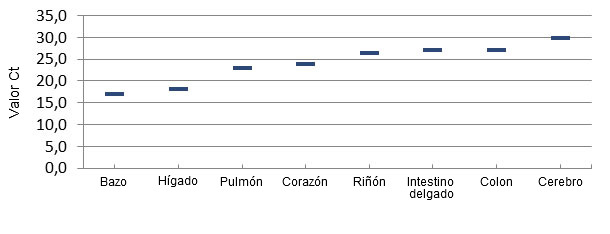
Figura 3 – Distribución del virus por PCR cuantitativa en tejidos de lechones afectados por ETNL.
Junto con el síndrome ETNL, en algunas granjas se produjeron casos de enfermedad vesicular idiopática con lesiones moderadas o leves en el hocico y/o pezuñas (bandas coronarias, área interdigital o almohadillas plantares) (figura 4). En otras granjas no se describieron lesiones de tipo vesicular, sugiriendo que SVA necesita de otros factores que contribuyan a establecer la enfermedad (asumiendo que SVA causa la enfermedad). La IVD que acompañaba al ETNL también presentaba una naturaleza transitoria, con lesiones en el morro que curaban en unos días y las de las pezuñas en unas dos semanas.
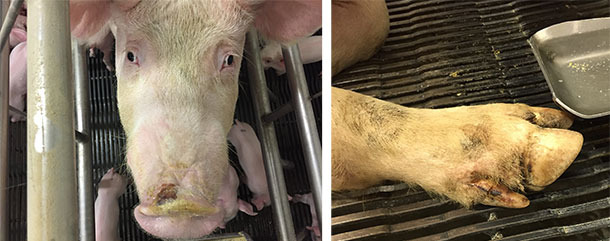
Figura 4. Lesiones en el morro y los pezuñas en los casos de enfermedad vesicular idiopática.
Importancia epidemiológica e implicaciones
ETNL se diseminó muy rápidamente en Brasil, con brotes agrupados temporal y espacialmente. En otras palabras, cuando se describía el síndrome en una granja concreta, era muy probable que las granjas vecinas también lo padeciesen, independientemente del sistema de producción, del flujo de cerdos/personas o de la fuente de genética o de nutrición. Hubo ejemplos en Brasil y en EE.UU. de explotaciones cerradas durante > 6 meses (que no introducían ni cerdas de reposición ni verracos externos) que tuvieron ETNL. En conjunto, estas observaciones sugieren que ETNL y/o IVD también se transmitieron por vías indirectas.
Hasta el momento, las primeras granjas que informaron del brote (septiembre de 2014) no han tenido rebrotes (que nosotros sepamos). En otras palabras, parece que ETNL fue de "episodio único", por lo menos después de un año. Teniendo en cuenta que la mayoría de las explotaciones tienen una tasa de reposición de ~45%, cada ~2 años la mayoría de las cerdas han sido reemplazadas, por lo que la ratio entre animales susceptibles:inmunes/resistentes puede cambiar significativamente. Esto puede causar oleadas de casos de ETNL cada 1,5 a 2,0 años.
Asumiendo que tanto ETNL como IVD estén causados por SVA, este virus tiene una elevada tasa de transmisión (a nivel regional y de granja), es muy inmunogénico y genera una inmunidad de larga duración (al menos 1 año).
Un estudio reciente de epidemiología molecular (Jianqiang et al. ASM science, aceptado; Vannucci, Linhares et al 2015) mostró que los aislados contemporáneos de SVA (EE.UU. y Brasil, de casos de ETNL y/o IVD) se agrupaban separadamente de la mayoría de aislados históricos de SVA, sugiriendo que SVA podría haber cambiado recientemente y aumentado su patogenicidad. Otra posibilidad es que el reciente incremento de casos clínicos asociados con SVA podría deberse a cambios (aumento) en la tasa de transmisión y/o supervivencia ambiental de SVA.
Todavía tenemos que entender cómo y dónde se "esconde" SVA entre brotes y cómo se transmite entre granjas. En otras palabras, ¿Puede SVA permanecer infeccioso en ingredientes del pienso? ¿Puede ser transportado por el aire? ¿Por vectores? Todavía se necesita mucha más investigación para responder a estas preguntas.
Avanzando
Se están llevando a cabo varios trabajos de investigación para abordar temas como a) desarrollar / validar un ELISA para SVA, b) confirmar el papel de SVA en ETNL/IVD, c) entender la epidemiología molecular de SVA en Brasil y en EE.UU., d) protocolos de desinfección frente a SVA.
Debe realizarse una investigación frente a enfermedades exóticas en cada caso detectado de IVD para descartar las otras 4 enfermedades vesiculares (incluyendo aftosa).
Agradecimientos
Dr. David Barcellos, de la universidad estatal de Iowa y al equipo de investigación y extensión de la Universidad de Minesota.


