Factores que afectan sobre la calidad y conservación del semen porcino - Parte 2
En la primera parte, hablamos sobre los características propias del animal que pueden afectar la calidad seminal, ahora hablaremos sobre las cualidades del eyaculado, el tipo de agua y de diluyente a utilizar para la formulación de dosis seminales.
Dilución
Apariencia, Color y Olor
Debe ser de volumen considerable (>150 ml) y dependiendo de la concentración, debe ser de color blanco lechoso. Ocasionalmente, pequeñas cantidades de sangre, provenientes de la uretra, pueden estar presentes en la eyaculación, lo que le da al semen un tono rosado. Esto normalmente no reduce la fertilidad o la viabilidad de la eyaculación, pero un color rojo más oscuro debe ser motivo para desechar la colección.
El semen recolectado no debe tener un olor perceptible. El olor que emite refleja los fluidos del prepucio (orina) que generalmente están muy cargados de bacterias y contaminantes extraños (Rozeboom, 2000).
Temperatura
La temperatura del eyaculado al momento de la recolección es de aproximadamente 37 °C y es de 32-35 °C al llegar al laboratorio. Se puede utilizar una dilución de dos pasos en la que el semen se diluye primero (1:1) con diluyente precalentado (33 °C) y luego se diluye en un diluyente precalentado o en un diluyente mantenido a temperatura ambiente (Lopez Rodriguez et al.,2017).
Ante el choque térmico, las colas de los espermatozoides se enrollarán alrededor de la cabeza o se enrollarán en espiral debajo de la cabeza del espermatozoide. Más del 10% de colas rizadas en asociación con una temperatura de menos de 32 °C es una buena indicación de shock por frío (Rozeboom, 2000).
La fragilidad del espermatozoide al choque térmico está relacionada con la composición lipídica de la bicapa de la membrana. Además, la relación colesterol/fosfolípidos es muy baja y el colesterol se distribuye asimétricamente, estando más presente en la monocapa externa que en la interna, haciendo que esta última sea especialmente vulnerable al choque por frío (L. A. Johnson et. Al., 2006).
Las temperaturas de almacenamiento por encima de los 18°C por períodos cortos de tiempo (< 24 horas) parecen no afectar los espermatozoides, pero conducen a una mayor utilización de los productos diluyentes y al crecimiento bacteriano. Por el contrario, si el semen diluido se expone a temperaturas de almacenamiento de 10 °C o menos, se pueden producir daños irreversibles (Althouse, 2001).
Concentración
La tasa de dilución final de los espermatozoides en el diluyente debe depender de la calidad inicial de la eyaculación, el tipo de diluyente y la duración prevista del tiempo de almacenamiento (Gary C. Althouse, 2001).
Una tasa de dilución alta (1 × 109 espermatozoides/80 ml) resulta en una menor motilidad de los espermatozoides durante el almacenamiento en comparación con una dilución más baja (2,5 × 109 espermatozoides/80 ml) (Lopez Rodriguez et al.,2017), mientras que el semen subdiluido, produce el agotamiento de los sustratos energéticos disponibles y los amortiguadores en un período de tiempo más corto. (Althouse, 2001).
Motilidad masal
Un estudio reciente que evaluó e inseminó eyaculados divididos poco tiempo (<24 h) después de la recolección sugiere que las tasas de parto y el tamaño de las camadas disminuirán cuando la motilidad inicial del semen se registre y se use a niveles inferiores al 62,5 %. Sin embargo, debido a que la motilidad del semen disminuye durante el almacenamiento, las tasas mínimas de motilidad durante la evaluación inicial del semen en el semental deben ser más altas que el 80 % ( Rozeboom, 2000)
Morfología
El nivel de procesamiento inicial para los espermatozoides normales debería ser superior a 70 % de morfología normal. Las deformidades en la forma de la cabeza, la formación de la cola y las gotitas citoplásmicas deben contarse como espermatozoides anormales. La fertilidad, medida por las tasas de parto y el tamaño de la camada, disminuye gradualmente a medida que aumenta la prevalencia de gotitas proximales. El mismo efecto ocurre con las gotitas distales, que, a su vez, se encuentran con más frecuencia. La incidencia de gotitas de plasma no debe exceder de 15%. (Rozeboom, 2000). El alto porcentaje de espermatozoides con gotitas citoplasmáticas o con defectos se correlaciona negativamente con la capacidad de unirse al epitelio del oviducto (Bernardi, 2008).
Además de la incidencia de gotitas citoplasmáticas, el porcentaje de otras alteraciones morfológicas no debe superar el 20% (L. A. Johnson et. Al., 2006)
Integridad del acrosoma y la cromatina
La membrana del acrosoma cubre los 2/3 superiores de la cabeza del espermatozoide y contiene las enzimas necesarias para la penetración de los ovocitos. Debería observarse encima del 51 % de acrosomas normales (Rozeboom, 2000). La integridad de la membrana plasmática es un requisito esencial para el metabolismo y la función de los espermatozoides. La integridad de la membrana espermática se puede evaluar con tinción de eosina-nigrosina o con el uso de colorantes fluorescentes.
La integridad de la cromatina se puede evaluar por el grado de susceptibilidad del ADN a la desnaturalización inducida, por ejemplo, por un pH bajo. La evaluación de la integridad de la cromatina puede ser altamente predictiva del fracaso de la fertilización (Bernardi, 2008).
Agua
No cualquier tipo de agua es válida para permitir la supervivencia de las células espermáticas. El agua de red, por ejemplo, contiene carbonato de calcio, carbonato de magnesio, nitratos, fosfatos, desechos químicos, compuestos orgánicos, microorganismos y endotoxinas.
Los espermatozoides de cerdo son muy sensibles al enfriamiento. Un aspecto muy relacionado al enfriamiento es la osmolaridad, ya que este es un parámetro dependiente de la temperatura.
Así, los espermatozoides precisan de condiciones específicas para su conservación óptima:
- pH entre 6.8 y 7.6
- Osmolalidad de entre 280 y 330 miliosmoles/kg
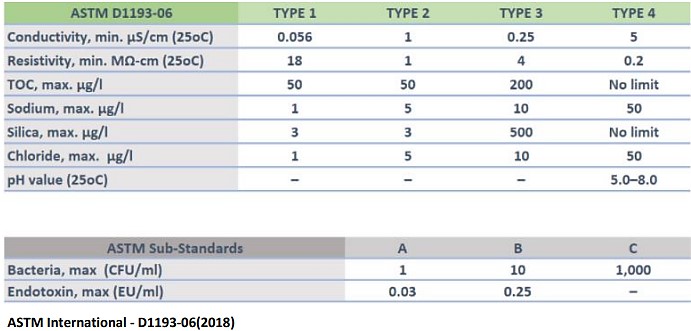
Para clasificar la calidad del agua purificada existen diversos entes como el Sistema ASTM (Sociedad Americanapara Pruebas y Materiales) que reconoce 4 tipos diferentes de agua:
La utilizada en granja generalmente es la Tipo II.
Diluyente
Los factores importantes son el pH, la fuerza iónica, el tipo de iones y la presión osmótica del medio. Y las sustancias antimicrobianas también se incluyen comúnmente en los diluyentes.
En el semen del padrillo recién eyaculado el pH varía entre 7,2 y 7,5, y por debajo de este la motilidad y el metabolismo de los espermatozoides se reducen gradualmente. El alto contenido de glucosa de la mayoría de los diluyentes para semen porcino provoca una reducción considerable del pH intracelular por debajo de 6,0. Esta acidosis intracelular obviamente permite que las células sobrevivan al almacenamiento. Además, debe poseer bicarbonato de sodio y citrato de sodio y/o cloruro de potasio como efecto tampón (L. A. Johnson et. Al., 2006).
REFERENCIAS:
- PRINCIPALES PUNTOS CRÍTICOS EN UN CENTRO DE INSEMINACIÓN, 2007. Rafael Arlegui González
- Estudio del metabolismo energético de los espermatozoides porcinos y su repercusión en el diseño de diluyentes optimizados para la conservación de semen refrigerado, 2005. Bellaterra.
- Evaluación in vitro de la viabilidad del semen porcino hasta 120 horas de almacenamiento en refrigeración. Orlando Díaz, H. Mesa, Germán Gómez, Francisco Javier Henao; 2008.
- Storage of boar semen at 16-18 °C in the long-term commercial extender prepared with deionized water or nanowater, 2019. Joanna Szymanowicz, Tomasz Schwarz, Maciej Murawski, Martyna Małopolska, Zdzisław Oszczęda, Ryszard Tuz, Jacek Nowicki, Pawel Mieczyslaw, Bartlewski.
- PHYSICAL AND CHEMICAL PARAMETERS OF BOAR SPERM,2008. ILINCA FRUNZĂ, H. CERNESCU, GABRIELA KORODI
- Boar management and semen handling factors affect the quality of boar extended semen, 2017. Alfonso Lopez Rodriguez, Ann Van Soom, Ioannis Arsenakis and Dominiek Maes.
- https://forum.atlashighpurity.com/blog/astm-and-iso-water-quality-standards-for-laboratory-grade-water.
- Tecnologias aplicadas no exame do ejaculado suíno para a produçãode doses de sêmen de alta qualidade. Acta Scientiae Veterinariae, vol. 36, núm. 1, 2008, pp. s5-s16 Universidade Federal do Rio Grande do Sul. Porto Alegre, Brasil. Bernardi. Mari Lourdes.
- Evaluating Boar Semen Quality. Animal Science Facts. Publication Numer ANS00-812S. Extension Swine Husbandry, 2000. Kevin J. Rozeboom Extension Swine Specialist.
- Semen Collection, Evaluation and Processing in the Boar, 2000. Gary C. Althouse, University of Illinois Donald G. Levis, University of Nebraska John Diehl, Clemson University
Contacto:
Contacta con nosotros a través del siguiente formulario.
Un resumen semanal de las novedades de 3tres3 Argentina
Accede y apúntate a la lista