Introducción
Hasta principios del año pasado, se consideraba que la enfermedad vesicular (EV) en cerdos estaba causada por uno de los cuatro virus RNA siguientes: virus de la fiebre aftosa (FAv, aftovirus de la familia Picornaviridae), virus de la estomatitis vesicular (VSIv, también conocido como VSv, vesiculovirus dentro de los Rhabdoviridae), virus del exantema vesicular porcino (VESv, vesivirus perteneciente a los Caliciviridae) o el virus de la enfermedad vesicular porcina (EVPv, enterovirus dentro de los Picornaviridae). En este caso clínico me voy a referir a ellos como los "4 grandes" virus de la EV.

Sin embargo, ha habido casos esporádicos en todo el mundo (incluyendo Nueva Zelanda, Italia, EE.UU. y Brasil) en los que se ha informado de enfermedad vesicular en poblaciones porcinas negativas a los 4 virus. En algunos casos se detectó Senecavirus A (SVA) en poblaciones porcinas con EV en ausencia de los 4 grandes virus. Estos casos fueron descritos como "enfermedad vesicular idiopática", ya que la relación causal entre el SVA y la EV no estaba clara.
SVA es un virus RNA que pertenece a la familia Picornaviridae (junto al FAv y al EVPv). Anteriormente se conocía como virus Seneca Valley. SVA es conocido en la literatura humana por sus propiedades oncolíticas. De hecho hay ensayos clínicos con SVA en humanos para el tratamiento del cáncer. Se sabe que SVA puede replicarse en cerdos, vacuno y roedores. Recientemente se han descrito dos casos clínicos asociados a SVA en cerdos: mortalidad neonatal epidémica transitoria (ETNL) y enfermedad vesicular.
En este artículo describiremos la aparición clínica de EV asociada a la identificación de SVA.
Caso
La granja: Se trata de una explotación de 8.000 cerdas en ciclo cerrado, todas situadas en la misma granja en el sureste de Brasil, que consta de varias naves con ventilación natural. La reposición se produce en la misma granja. El semen se compra en un centro de IA externo que lo sirve 3 veces por semana (lunes, miércoles, viernes). El personal trabaja exclusivamente en esta granja y los suministros/equipos no se comparten con otras granjas. En general, la granja tiene unas buenas prácticas de bioseguridad (vacío sanitario, duchas al entrar y salir, relativa poca frecuencia de movimiento de cerdos, los camiones se lavan, desinfectan y se dejan secar durante 24h antes de volver a cargar cerdos, región con poca densidad porcina). Esta granja no ha tenido historial previo de EV en sus 10 años de existencia. Es PRRSv-negativa, Mycoplasma hyopneumoniae-positiva. Las naves de engorde tienen 30 cerdos por corral y las transiciones 60 lechones por corral.
Aparición de la enfermedad clínica:
Días 1-3: El personal de la granja nota que los cerdos de engorde están menos activos de lo habitual, pero no comentan nada con el veterinario de la granja. No se observan lesiones ni cojeras.
Días 4-10: alrededor del 25% de los cerdos de engorde y el 15% de la transición están cojos. El día 9 se contacta con el veterinario, que visita la granja el día 10 pensando en Mycoplasma hyosynoviae. Durante la visita se realiza una inspección clínica detallada a los cerdos de todas las edades. Se detectan algunas pequeñas lesiones interdigitales, en las almohadillas plantares y en las bandas coronarias en la mayoría de los cerdos cojos (>90%) de los corrales de engorde y algunos de la transición (~ 30%).
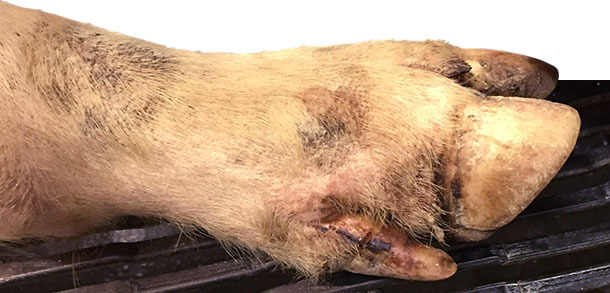
También se encuentran vesículas de 0,5 a 1,5 cm de diámetro en los hocicos de los cerdos de engorde en un 1% de los animales (aproximadamente un cerdo cada ~ 3 corrales). Sólo se detectan 2 vesículas en hocicos en la transición.
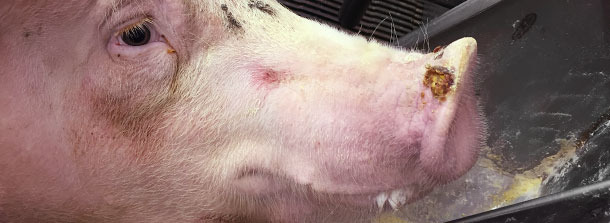
El veterinario de la explotación llama a los servicios veterinarios oficiales, que abren una investigación para detectar si se trata de una enfermedad animal exótica. Se envían fluidos vesiculares e hisopos de las bandas coronarias de algunos cerdos afectados para su diagnóstico veterinario oficial y, tras 3 días, resultan ser negativas a los 4 grandes virus. Todas las muestras fueron positivas a RNA de SVA mediante RT-PCR. En ese momento (otoño 2014), no había tests serológicos para SVA.
Mientras tanto, los cerdos continúan siendo examinados diariamente para ver la evolución y/o recuperación de los síntomas clínicos asociados a EV. No se observan cojeras ni EV en la población reproductora (cerdas). Los lechones neonatos del grupo afectado tienen un aumento temporal de la mortalidad del 50% durante unos 7 días, pero la mortalidad vuelve a sus niveles habituales y no se observa EV ni en las cerdas ni en los lechones.
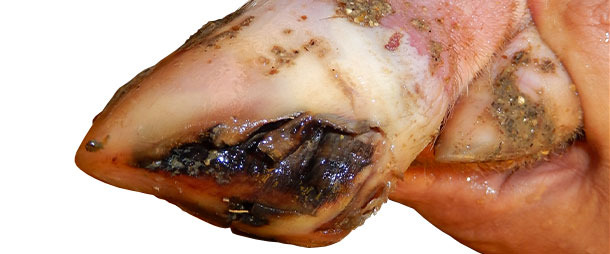
En los cerdos de transición y engorde siguen apareciendo nuevos casos de cojeras y síntomas de EV más leves con una tasa de incidencia de alrededor del 5% por semana durante 4 meses tras la aparición del caso.
Cuando los cerdos empiezan a mostrar cojera se les marca con spray de color para examinarlos diariamente. Se detecta EV en la mayoría de cerdos cojos – tanto en el día 0 de la cojera como al cabo de 1-2 días. Las lesiones de EV se curan completamente en 7-10 días. No hay ningún cambio significativo en la mortalidad en la fase de crecimiento.
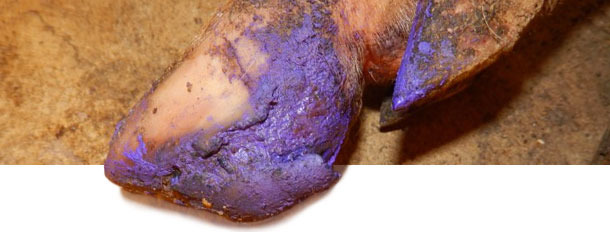
Entre los 4 y 5 meses tras la aparición del caso, la incidencia de lesiones de tipo EV disminuye hasta casi cero. En este momento, la granja lleva 6 meses sin EV ni aumento del número de cojeras. El tratamiento de los cerdos afectados dependía de la gravedad de las lesiones de EV. Los que tenían lesiones graves recibían un cuidado básico de las pezuñas para ayudar a su recuperación, mientras que a los cerdos con lesiones más graves se les inyectaban antibióticos + antiinflamatorios para evitar complicaciones por infecciones secundarias.
Comentarios finales
Recientemente se ha llevado a cabo un estudio conjunto entre la Universidad Estatal de Iowa (ISU) y el departamento de agricultura de EE.UU. (USDA) que se dió a conocer en la ISU Swine Disease Conference en Ames, Iowa, EE.UU., que encontró evidencias de EV producida por aislados de SVA de cerdos de producción con clínica de EV. Por lo tanto, SVA puede considerarse uno de los agentes etiológicos de EV en cerdos, junto con los otros 4 grandes (ahora los 5 grandes).
Aunque la EV causada por SVA es más leve y más corta en comparación con el FAv, el desarrollo inicial de las lesiones de EV es clínicamente indistinguible del de FAv. Debe llevarse a cabo un diagnóstico por los servicios veterinarios oficiales para descartar FAv y no hacerse suposiciones del tipo "debe ser otro caso de SVA" cuando se sepa que SVA esté circulando y causando EV en poblaciones de cerdos cercanas.
En este caso concreto, no pudimos confirmar la fuente de origen del virus. Se sabe que otras granjas de la zona habían informado de mortalidad neonatal epidémica transitoria asociada a SVA y/o lesiones de EV (al menos 8 granjas en un radio de 10 km). Las especulaciones incluyen mosquitos (otros picornavirus son transmitidos por vectores), aerosoles, ingredientes del pienso, vacunas y vehículos de transporte de cerdos.
Este caso es un gran ejemplo de que los patógenos inesperados pueden aparecer en cualquier momento. Las prácticas de bioseguridad deben revisarse permanentemente e implementarse diariamente (constantemente).



