Ensayos disponibles
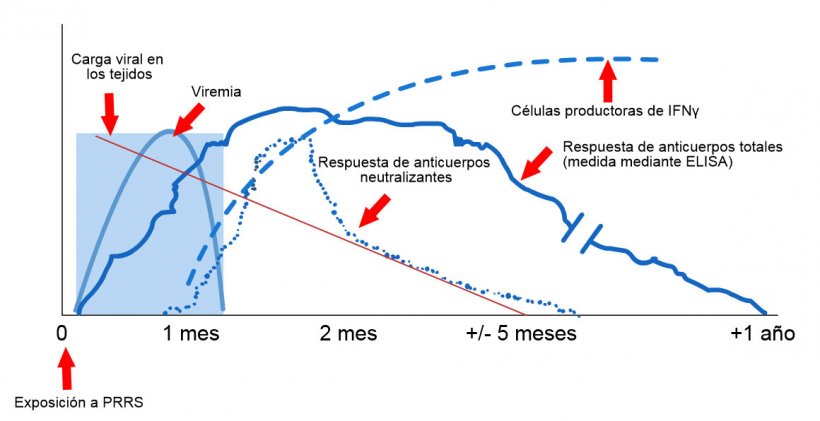
Esquema de detección de virus y anticuerpos después de la exposición al PRRS: El siguiente gráfico muestra los cambios en la concentración (eje Y) a lo largo del tiempo (eje X) de los diferentes analitos utilizados en los ensayos. Después de la exposición al virus del PRRS, aparece virus en la sangre (viremia) que suele durar entre 2 y 4 semanas, dependiendo de la edad y el estado inmunológico del cerdo. La seroconversión (detección de anticuerpos) suele ocurrir entre 7 y 10 días después de la exposición y dura varios meses antes de volverse seronegativa. Los anticuerpos neutralizantes aparecen entre 4 y 6 semanas después de la exposición (López y Osorio, 2004).

Reacción en cadena de la polimerasa (PCR)
- Detecta la presencia de secuencias específicas de ácido nucleico viral (ARN).
- Tipos de muestras: tejidos, sangre, suero, fluidos orales, etc.
- Pros:
- Se usan cebadores independientes para detectar PRRS tipo 1 (europeo) y tipo 2 (norteamericano) simultáneamente en la misma muestra.
- Sensibilidad muy alta (puede detectar pequeñas cantidades de virus).
- Detección temprana: los casos agudos deberían ser positivos.
- Se pueden utilizar muchos tipos diferentes de muestras (tejido, sangre, suero, fluidos orales, etc).
- Coste moderado:
- A menudo se pueden combinar 5 muestras de suero o tejido para reducir el coste y minimizar la pérdida de sensibilidad.
- No se suelen hacer pooles de muestras de fluidos orales debido a que el valor Ct (número de ciclos necesarios para amplificar el RNA viral hasta alcanzar un nivel detectable) será más alto (porque las concentraciones de virus son más bajas), lo que puede comportar una pérdida significativa de sensibilidad.
- Contras:
- El laboratorio debe actualizar los cebadores periódicamente para evitar falsos negativos.
- Se deben actualizar tanto los cebadores para el PRRS tipo 1 como para el tipo 2.
- Hace falta secuenciación para diferenciar el virus vacunal de la infección por el virus de campo.
- El laboratorio debe actualizar los cebadores periódicamente para evitar falsos negativos.
Ensayo por inmunoabsorción ligado a enzimas (ELISA)
- Detecta la presencia de anticuerpos.
- Tipos de muestras: suero o fluidos orales (algunos kits).
- Pros:
- La mayoría detectan anticuerpos de ambos tipos de PRRS.
- Los animales permanecen positivos durante varios meses (3-12 meses).
- Puede utilizarse en casos crónicos.
- Contras:
- Los anticuerpos específicos y el momento de la detección pueden variar ligeramente entre los distintos kits comerciales disponibles.
- Los animales tardan entre 7 y 10 días en volverse seropositivos.
- No diferencia entre anticuerpos maternales y los de exposición.
- No distingue entre vacunación e infección por virus campo.
Inmunohistoquímica (IHC)
- Detecta la presencia de antígenos virales.
- Tipos de muestra: tejidos.
- Pros:
- Detecta al virus en el sitio de la lesión (buena prueba de causalidad).
- Permite diferenciar entre cantidades bajas, moderadas y altas de virus presentes.
- Contras:
- Tiene que enviarse la muestra de tejido correcta.
- Requiere que haya una cantidad de virus significativamente mayor que la PCR.
- Sólo evalúa una pequeña cantidad de tejido.
Secuenciación genética
- Secuencia los ácidos nucleicos genéticos del virus (ARN).
- Tipo de muestras: tejidos, sangre, suero, fluidos orales, etc.
- Pros:
- Permite diferenciar entre el virus de campo y las vacunas.
- Puede ayudar a diferenciar la introducción de nuevos virus respecto a los existentes o los del pasado.
- Contras:
- Caro.
- A menudo, sólo se secuencia la ORF5, que representa 600 pares de bases de unos ~15.000.
- Las muestras con valores CT elevados (> 34) tienden a ser más difíciles de secuenciar.
Tabla 1: Éxito de las secuenciaciones de la Iowa State University Veterinary Diagnostic Laboratory según los valores del umbral de ciclo de PCR para PRRS (Ct) en muestras de fluidos orales. Chris Rademacher et al. 2016.
| Muestra | Rango de Ct de la PCR | Total de muestras analizadas | Número de muestras secuenciadas | % muestras positivas secuenciadas |
|---|---|---|---|---|
| Todas las muestras | <30 | 2016 | 2013 | 99,85 |
| 30,00-31,99 | 389 | 361 | 92,80 | |
| 32,00-33,99 | 324 | 265 | 81,79 | |
| 34,00-35,99 | 185 | 109 | 58,92 | |
| 36,00-37,00 | 65 | 26 | 40,00 |
Anticuerpos fluorescentes indirectos (IFA)
- Detecta la presencia de anticuerpos.
- Tipos de muestras: suero.
- Pros:
- Junto con la PCR, puede servir para confirmar una muestra inesperadamente positiva a ELISA.

Diagrama que muestra el uso de PRRS IFA como prueba confirmatoria para muestras que salen inesperadamente positivas a PRRS mediante ELISA. Una muestra de la que se sospecha que es negativa y sale negativa a ELISA se considera negativa. Si esta muestra da positiva inesperadamente, se puede realizar una IFA de PRRS como prueba de confirmación. Si la prueba IFA es positiva, se confirma que la muestra es positiva. Si la prueba de IFA es negativa, asumiremos que fue un falso positivo siempre que la PCR también sea negativa para confirmar que no hay infección reciente.
- Junto con la PCR, puede servir para confirmar una muestra inesperadamente positiva a ELISA.
- Contras:
- No es factible para números grandes de muestras.
- Los resultados dependen del aislado vírico usado en el ensayo.
- La fiabilidad depende mucho de la habilidad de los técnicos.
Interpretación de resultados
PCR
- Positivo – El virus está presente/circulando, lo que es muy sugerente de causalidad, especialmente en los valores de Ct más bajos y presencia de signos clínicos. La vacunación reciente con un virus vivo modificado puede dar lugar a PCR positivas.
- Negativo – Negativo o el virus no se detecta si la prueba se realiza mucho después de la infección.
ELISA
- Positivo – Anticuerpos maternales o exposición anterior (normalmente > 7-10 días) a vacuna o virus campo.
- Negativo – Negativo o infección demasiado reciente para ser detectada (normalmente debe ser, al menos, 7-10 días post-exposición).
IHC
- Positivo – El virus está presente en el sitio de la lesión.
- Negativo – Negativo o infección demasiado antigua para detectar virus.
Secuenciación genética
- Virus vacunal – Se espera una homología > 99%
- Virus de campo – Se estima una pérdida de homología de 1-2% anual.
IFA
- Positivo – Anticuerpos maternales o exposición anterior (> 7-10 días) a vacuna o virus de campo.
- Negativo – Negativo o infección demasiado temprana para poder detectarla (debe ser, al menos, 7-10 post-exposición).
Escenarios

Abortos de cerdas/nulíparas
- Fetos abortados: Recoge 6-8 fetos para hacer un pool de las muestras para PCR. Sólo alrededor del 50% de los fetos serán PCR positivos (por lo que es necesario muestrear muchos fetos), pero los positivos tendrán una elevada concentración vírica por lo que pueden hacerse pooles de 10 muestras para la PCR.
- Cerdas/nulíparas abortadas: Recoge suero de cerdas/nulíparas abortadas recientemente (< 10 días) para PCR. Pueden mezclarse en grupos de 5. Los tests ELISA no son útiles ya que las cerdas/nulíparas no expuestas tardarán 7-9 días en ser positivas.
Problemas reproductivos en cerdas/nulíparas
- Recoge 15 a 20 muestras de hembras afectadas y 15 a 20 de las no afectadas (30 – 40 muestras en total) y analízalas mediante PCR (pooles de 5 o 6) y ELISA (individualmente).
Lechones nacidos débiles
- Puedes recoger fluidos orales familiares de varias camadas con lechones débiles y analizarlos mediante PCR.
- Puedes recoger testículos (si castras), colas, lenguas (de animales muertos) de lechones de diferentes camadas en la sala de maternidad. Pueden hacerse pooles de muchas muestras para el análisis.
- Recoge muestras de suero de 10 camadas afectadas (2 o 3 lechones por camada) y analízalas mediante PCR en pooles de 5 o 6. Asegúrate de que los lechones no hayan sido vacunados frente a PRRS.
Cerdos de engorde con signos clínicos agudos de PRRS
- Recoge fluidos orales de 4 a 6 corralinas diferentes y analízalos individualmente mediante PCR. No hacer pooles con las muestras.
- Recoge muestras de suero de 15 a 30 de cerdos con signos clínicos o haz un muestreo aleatorio y analízalos mediante PCR. Puedes hacer pooles en grupos de 5 o 6.
Cerdos de engorde con signos clínicos crónicos de PRRS
- Recoge fluidos orales de 4 a 6 corralinas diferentes y analízalos individualmente mediante PCR. No hacer pooles de las muestras.
- Recoge 30 muestras séricas de cerdos con signos clínicos o haz un muestreo aleatorio y analízalos mediante PCR. Puedes mezclarlos en grupos de 5 o 6. También puedes analizar muestras individuales mediante ELISA para confirmar la exposición.



