La integridad del epitelio y la secreción mucosa representan la primera barrera física de defensa contra antígenos, toxinas y microorganismos. Además, las células epiteliales y de inmunidad innata secretan proteínas antimicrobianas (AMPs) en respuesta a patógenos.
La defensa más importante contra patógenos primarios u oportunistas está representada por células de inmunidad innata y adquirida asociadas a la superficie mucosa, organizadas en estructuras bien definidas llamadas tejidos linfoides asociados a mucosas (MALT), e.g. tejido linfoide asociado a intestino (GALT), PP (placas de Peyer), BALT (tejido linfoide asociado a bronquios), NALT (tejido linfoide asociado a nasofaringe), etc., o diseminadas en el epitelio y la lámina propia.

La expresión de PRRs, principalmente de TLRs y receptores tipo NOD (NLRs), en células epiteliales y de inmunidad innata modula el reconocimiento y la respuesta inflamatoria/inmune contra microorganismos.
La inmunidad de la mucosa intestinal se desarrolla desde el nacimiento, asociada a la colonización de la microbiota que impulsa la maduración inmunitaria y la expansión de estructuras GALT, lo que influye en la aparición de subpoblaciones efectoras de linfocitos y células B implicadas en la producción de IgA. Diferentes subpoblaciones de CD4, CD8, linfocitos γδT y células de inmunidad innata se localizan en la lámina propia y el epitelio (figura 1).
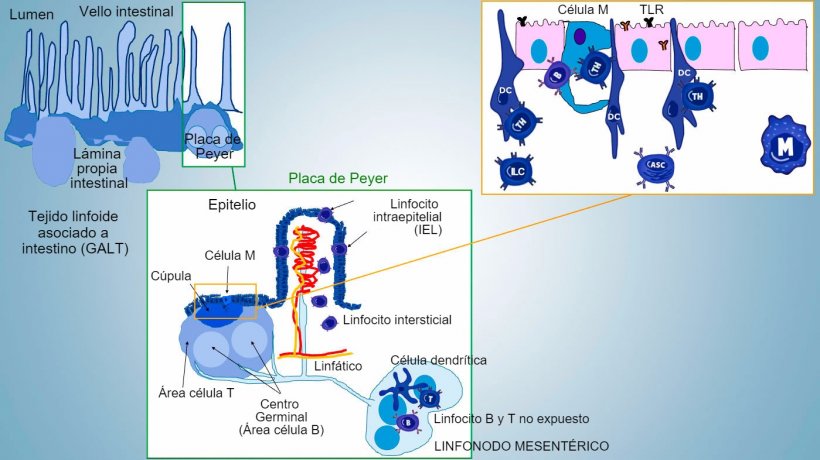
Figura 1: Representación esquemática de los tejidos linfoides asociados a intestino: placas de Peyer (PPs), folículos aislados y linfonodos mesentéricos.
Los subconjuntos más importantes de Thelper que se diferencian en la lámina propia intestinal son los linfocitos T reguladores (Treg), Th1, Th2 y Th17. Las células linfoides innatas (ILCs) también desempeñan un papel clave en la respuesta inmune de superficies barrera, interactuando con otras células de inmunidad innata y adquirida, principalmente con Th17.
Además, la microbiota intestinal inhibe la colonización y el sobrecrecimiento del patógeno al proporcionar señales que sustentan algún mecanismo innato, por ejemplo, la secreción de proteínas antimicrobianas.
En pulmón, los linfocitos Th1 citotóxicos CD4 y CD8 están presentes como células efectoras contra el patógeno intracelular, pero también están implicados otros subconjuntos que incluyen Th2, Th17, Treg y TFh.
La inmunidad de la mucosa es capaz de discriminar entre microorganismos comensales, antígenos de alimentos o aerosoles y patógenos primarios.
Los antígenos de aerosoles y alimentos, así como la flora comensal, generalmente no estimulan una respuesta inflamatoria/inmune sino que inducen una tolerancia inmunitaria (figura 2).
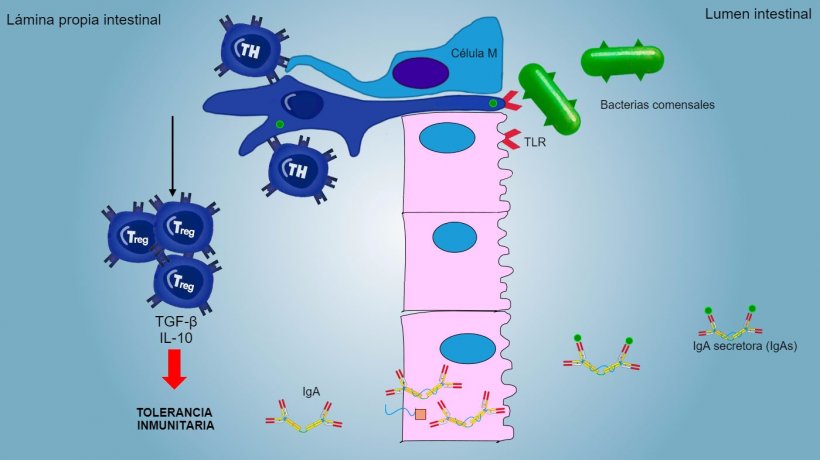
Figura 2: Una tolerancia inmunitaria es inducida frente bacterias comensales, mediada por linfocitos Treg con producción de citoquinas como IL-10 y TGFb. Particularmente, en el intestino, la secreción de IgA específica bloquea la adherencia de bacterias comensales, modulando así la composición de la microbiota y evitando su invasión y dispersión sistémica.
Funcionalmente, la respuesta inmune en superficie mucosa se diferencia en sitios inductivos y efectores:
- Sitios inductivos: PP, folículos linfoides aislados (ILF), NALT, BALT, linfonodos mesentéricos (MLN). Muestrean los antígenos y activan la respuesta inmune.
- Sitios efectores: lámina propia de la mucosa intestinal, tracto respiratorio superior, tracto genitourinario, glándula mamaria y salival. Genera una respuesta defensiva que induce la respuesta inmune inflamatoria/innata y específica.
En los sitios inductivos, los antígenos son capturados por las células M (con micropliegues) que los transportan internamente y los liberan en el espacio extracelular, donde son capturados y procesados por las células dendríticas subyacentes; las DC de la lámina propia también pueden capturar directamente al antígeno con sus prominencias citoplasmáticas, que se extienden entre los enterocitos.
En las PP, la presentación de antígeno a Thelper hace que las células B conmuten de clase hacia la producción y secreción de IgA en la lámina propia y el lumen intestinal como mecanismo efector defensivo (figura 3). De manera alternativa, las DCs intestinales cargadas de antígeno migran al linfonodo mesentérico induciendo una posterior activación de células B y T antígeno-específicas; luego, la migración de linfocitos B activados asegura la producción local de IgA y también una respuesta en superficie mucosa a distancia (figura 4).
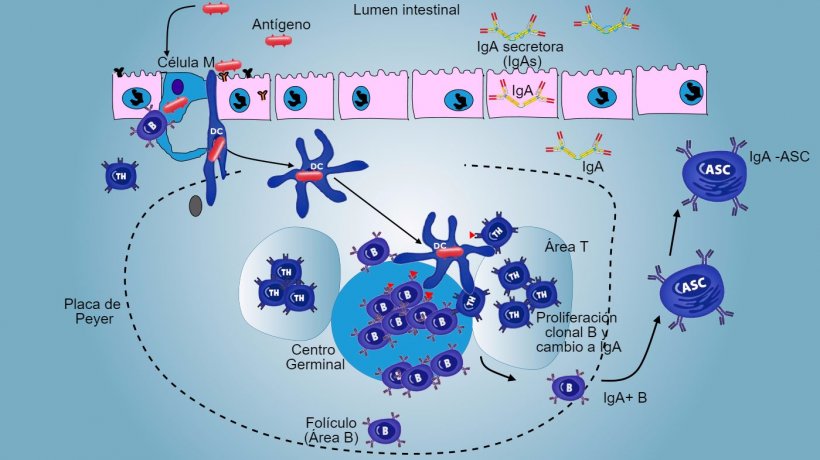
Figura 3: Producción de IgA en placas de Peyer.

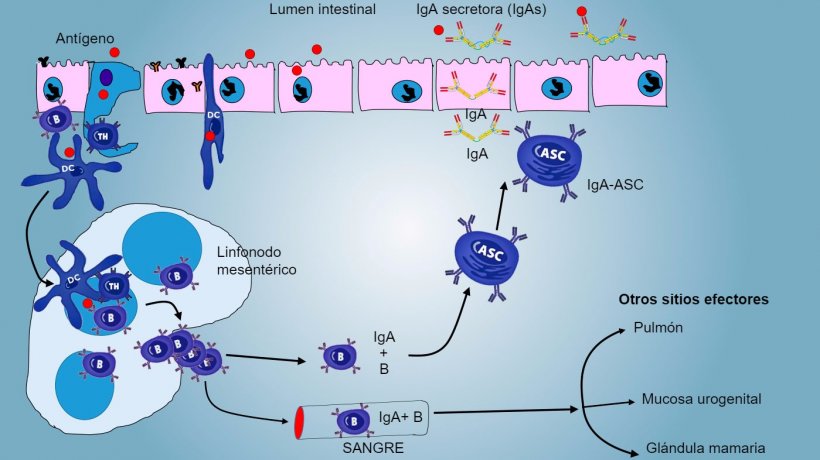
Figura 4: Producción de IgA en linfonodos mesentéricos y respuesta sistémica. Los linfocitos B y T en proliferación y activados emigran de la linfa a la sangre, en el cerdo directamente a través de las vénulas endoteliales altas (HEV), la mayoría regresando al intestino o alcanzando otras superficies mucosas (sitios efectores) como pulmón, glándula mamaria y aparato urogenital.
De forma similar, se ha demostrado la capacidad de inmunización nasal para conferir una respuesta inmune tanto local como distalmente, mediante el tráfico de células lejos del tejido linfoide asociado a bronquios.
En los sitios efectores, la respuesta inmune varía según el patógeno a enfrentar (figura 5).
En caso de infección de patógeno intracelular, se produce una respuesta inflamatoria mediada por TLR y NOD con una activación posterior de la respuesta inmune mediada por Th1 y la activación de células NK y linfocitos T citotóxicos capaces de matar y destruir células infectadas; esta respuesta podría estar asociada con una activación B eficaz y una secreción de anticuerpos de superfície.
Los linfocitos intraepiteliales γδT están implicados en la eliminación inicial de células infectadas o en la secreción de AMP, así como en la homeostasis intestinal.
Una respuesta mediada por Th17 juega un papel crítico en la protección de los sitios de la mucosa principalmente contra bacterias extracelulares, bacterias y hongos, pero también contra virus, en la lámina propia del intestino donde estos linfocitos están presentes de manera abundante. Durante una respuesta inflamatoria, los linfocitos Th17 activados por IL-23, secretan IL-17 e IL-22, citoquinas que impulsan la producción de péptidos antibacterianos y el reclutamiento y activación de granulocitos neutrófilos inflamatorios (figura 5).
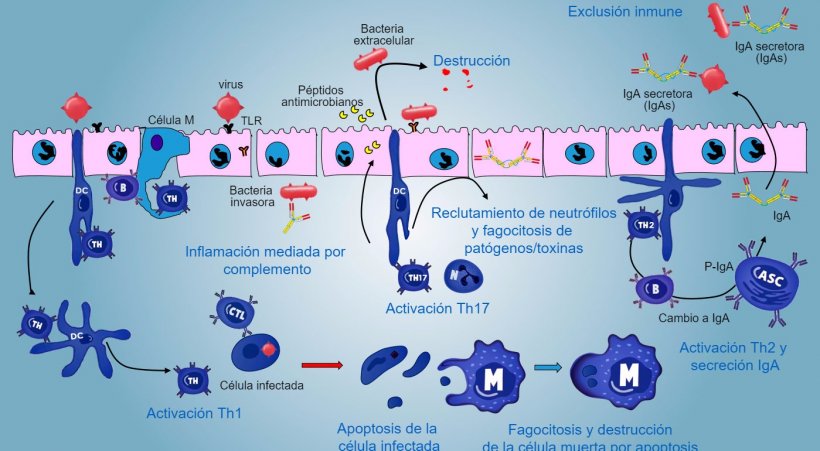
Figura 5. Una visión integrada de la respuesta inmune contra patógenos a nivel de mucosa.
En pulmón, la protección contra patógenos implica la producción de citoquinas inflamatorias (TNFa, IL-1β, MIP-1α y MIP-1β) y el reclutamiento de neutrófilos, macrófagos y linfocitos como células T CD4, células T CD8 y linfocitos Tγδ.
La producción y secreción de IgA secretora de anticuerpos es un mecanismo efector principal de la inmunidad de la mucosa (figura 6).
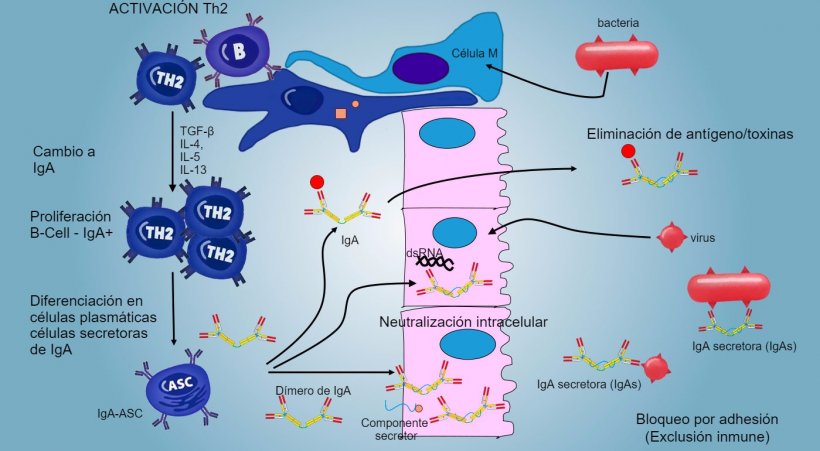
Figura 6: El "cambio" hacia IgA se regula principalmente mediante la activación de linfocitos Th2 con producción de citoquinas TGF-β, IL-4, IL-5, IL-13. El dímero de IgA secretado se une a un receptor (pIgR) en la superficie basal de las células epiteliales. El complejo se internaliza en la célula y, antes de migrar a través de la superficie luminal, el receptor se escinde y la IgA permanece unida al residuo del receptor (componente secretor).
IgA predomina en todas las superficies y secreciones mucosas; las células plasmáticas presentes en el tejido linfoide o la lámina de la mucosa realizan una secreción constante de IgA.
En las PP intestinales, la activación de linfocitos B genera células plasmáticas secretoras de IgA. Las IgA se secretan principalmente como dímeros de IgA donde dos monómeros se juntan mediante una cadena J y se unen a un componente secretor que protege s-IgA de la acción de enzimas proteolíticas intestinales. Las IgA evitan la adherencia de virus y bacterias a las células epiteliales (mecanismo de inmuno-exclusión), son capaces de unirse a proteínas virales dentro de la célula y bloquear la replicación (neutralización intracelular) así como unirse a antígenos penetrados en la mucosa y transportarlos a través del epitelio para eliminarlos en el lumen (eliminación de antígenos).
El "cambio" hacia IgA se regula principalmente mediante la activación de linfocitos Th2 con producción de citoquinas TGF-β, IL-4, IL-5, IL-13. El dímero de IgA secretado se une a un receptor (pIgR) en la superficie basal de las células epiteliales. El complejo se internaliza en la célula y, antes de migrar a través de la superficie luminal, el receptor se escinde y la IgA permanece unida al residuo del receptor (componente secretor).
A nivel respiratorio, IgA predomina en las zonas superiores (cavidades nasales, faringe, laringe, tráquea, bronquio), mientras que en las zonas inferiores (bronquial y alveolar) existe principalmente una respuesta inmune sistémica con participación de los linfonodos involucrados y secreción predominante de IgG.



