Test disponibles:
Puede ser beneficioso revisar el excelente resumen proporcionado en el artículo sobre la influenza de Phil Gauger:
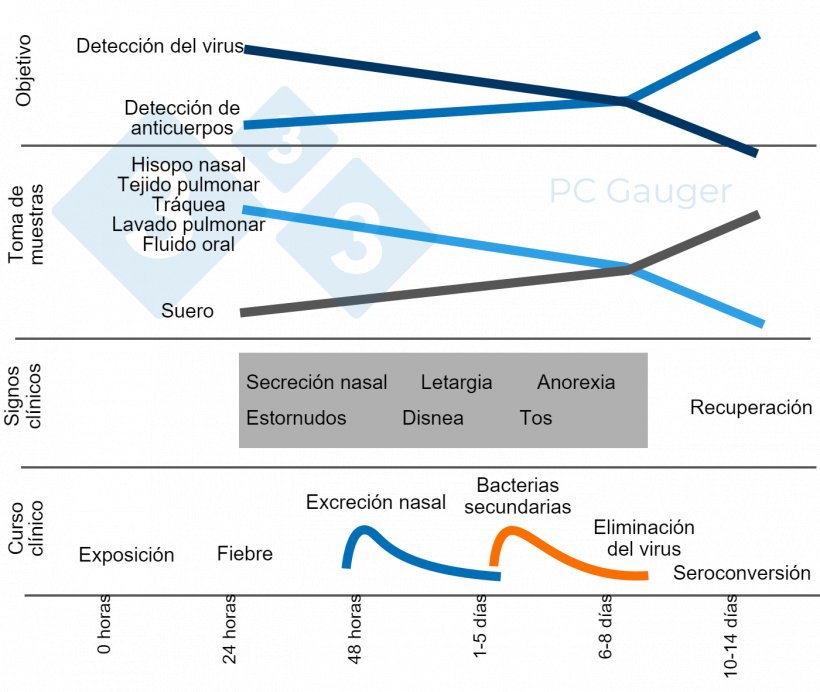
Figura 1. Toma de muestras dirigida a la detección directa o indirecta y al diagnóstico del virus de la influenza A en cerdos. La toma de muestras para la detección directa debe realizarse durante la excreción del virus, al principio del curso de la enfermedad. La detección indirecta de anticuerpos contra la influenza debe realizarse después de la eliminación del virus y va dirigida a la respuesta inmune contra la infección.
Patología macroscópica

- Evalúa la presencia de lesiones en tejidos que pueden sugerir la presencia de enfermedad.
- Ubicación de las lesiones:
- Consolidación craneoventral (especialmente en los lóbulos apical y cardíaco)
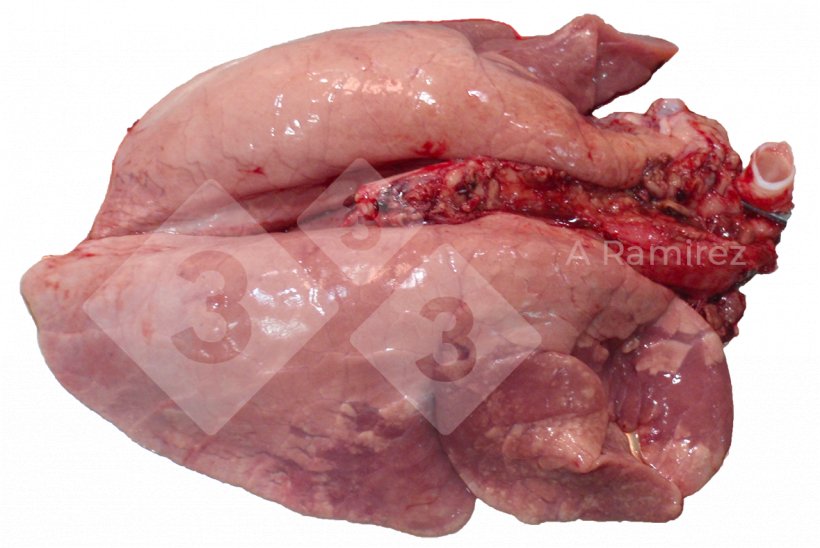
Figura 2. Consolidación pulmonar craneoventral frecuente en las infecciones por influenza A no complicadas. Estas lesiones son similares a las causadas por Mycoplasma hyopneumoniae.
- La presentación puede ser difusa cubriendo múltiples áreas del pulmón.
- Puede haber edema interlobular.
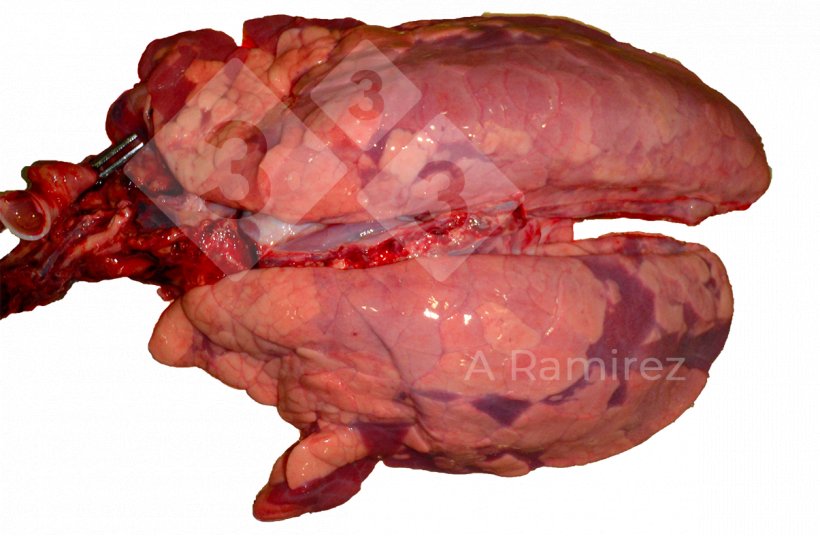
Figura 3: Infección por influenza A de presentación irregular y difusa con ligero edema interlobular.
- Pros:
- La gravedad de las lesiones puede relacionarse con la importancia clínica
- Contras:
- Lesiones macroscópicas no diagnósticas (muy similares a Mycoplasma hyopneumoniae)
- A menudo existen infecciones secundarias o coinfecciones
Histopatología
- Evalúa la presencia de lesiones que pueden confirmar la presencia de enfermedad.
- Tipo de muestra: tejido pulmonar.
- Pros:
- La bronquiolitis necrotizante suele considerarse patognomónica de la infección por el virus de la influenza A en cerdos
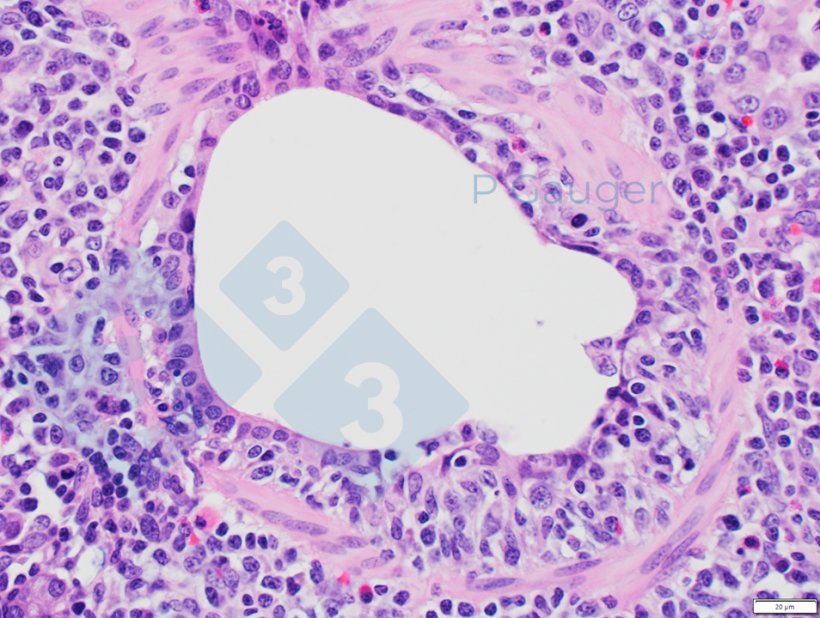
Figura 4: Histopatología pulmonar que muestra el adelgazamiento del epitelio bronquiolar, que es un ejemplo de necrosis. (Fuente de la foto: Phil Gauger ISUVDL)
- Las lesiones características aparecen unos días después de la eliminación del virus en el cerdo, especialmente cuando hay coinfecciones
- La bronquiolitis necrotizante suele considerarse patognomónica de la infección por el virus de la influenza A en cerdos
- Contras:
- Solo evalúa una pequeña cantidad de tejido
- Las lesiones no complicadas pueden resolverse rápidamente (5-7 días)
Inmunohistoquímica (IHC)
- Detecta la presencia de antígeno viral.
- Tipo de muestra: tejido pulmonar.
- Pros:
- Detecta el virus en el lugar de la lesión (buena prueba de causalidad)
- El antígeno diana suele ser una nucleoproteína que se conserva en todos los virus de la influenza A
- Contras:
- Solo evalúa una pequeña cantidad de tejido
- El virus solo está presente por un corto período de tiempo (pocos días)
- Requiere que haya una cantidad de virus significativamente mayor que la PCR
Aislamiento del virus
- Aísla el virus vivo.
- Tipos de muestras: tejido pulmonar, lavado broncoalveolar, hisopos nasales.
- Pros:
- Criterio de referencia.
- Aislamiento del virus para utilizarlo en el desarrollo de vacunas (vacunas autógenas) o pruebas serológicas (inhibición de la hemaglutinación) para determinar la protección cruzada
- Contras:
- Caro
- Resultados lentos
- Requiere huevos de gallina embrionados o células de riñón canino Madin-Darby (MDCK)
- El proceso de inoculación es muy laborioso
- A menudo difícil de cultivar (muchos falsos negativos)
- La manipulación de las muestras desde el campo hasta el laboratorio puede afectar a la supervivencia del virus
Reacción en cadena de la polimerasa (PCR)
- Detecta la presencia de una secuencia específica de ácido nucleico viral (ARN)
- Tipos de muestras: hisopos nasales, fluidos orales, tejido pulmonar, lavado broncoalveolar.
- Pros:
- Los primers (cebadores) pueden diseñarse para:
- Detección de todos los subtipos de virus de la influenza A - dirigido a la nucleoproteína conservada
- Detección de grupos de virus de subtipos específicos: subtipo H1, H3, N1 o N2
- Alta sensibilidad
- Detección temprana
- La cuantificación por PCR se asocia con la presencia de lesiones
- Costo moderado
- A menudo se pueden combinar muestras de hisopos o tejidos para reducir el costo y minimizar la pérdida de sensibilidad (especialmente en lo que respecta a la relevancia clínica)
- Los primers (cebadores) pueden diseñarse para:
- Contras:
- Alta sensibilidad – especialmente en fluidos orales puede detectar la presencia de pequeñas cantidades de virus en la granja, lo que dificulta la interpretación clínica de los resultados con respecto a la extensión o la gravedad de la enfermedad.
- El virus sólo está presente en el huésped durante unos días (3- 5 días especialmente en los hisopos nasales)
- No se pueden utilizar muestras de sangre o suero para la prueba PCR, ya que el virus permanece en el pulmón y no es sistémico.
Secuenciación genética
- Secuencia segmentos genéticos del ácido nucleico (ARN) del virus.
- Tipos de muestras: tejido pulmonar, hisopos nasales, lavado broncoalveolar, fluidos orales.
- Pros:
- Permite diferenciar entre subtipos en muchos niveles diferentes de clados
- H1: se divide en clados que suelen denominarse con el alfabeto griego (alfa, beta, gamma, etc.)
- H3: se divide en clústers que suelen denominarse con números romanos (I, IV, etc.)
- Muchos de estos clados o clústers relevantes se describen aquí.
- Puede ayudar a diferenciar la introducción de nuevos virus respecto a virus existentes o del pasado.
- Puede ayudar a seleccionar la cepas vacunales en función del subtipo/clado
- Permite diferenciar entre subtipos en muchos niveles diferentes de clados
- Contras:
- Caro
- Normalmente sólo se secuencia el gen HA
- La variabilidad entre subtipos/clados sigue creciendo y se está volviendo más compleja
Ensayo por inmunoabsorción ligado a enzimas (ELISA)
- Detecta la presencia de anticuerpos.
- Tipo de muestra: suero.
- Pros:
- Las pruebas ELISA pueden diseñarse para:
- Detección de anticuerpos de todos los subtipos - dirigido a la nucleoproteína conservada
- Detección de anticuerpos específicos de subtipo – dirigido a las proteínas específicas hemaglutinina (denominada H o HA) y/o neuraminidasa (denominada N o NA)
- Los animales permanecen positivos durante varias semanas (empiezan a disminuir después de 8-10 semanas)
- Puede utilizarse en casos crónicos
- Las pruebas ELISA pueden diseñarse para:
- Contras:
- Los anticuerpos específicos y el momento de la detección pueden variar ligeramente entre los distintos kits comerciales disponibles
- Los animales tardan entre 10 y 14 días en volverse seropositivos
- No distingue entre vacunación e infección por virus campo
- No identifica un subtipo específico de virus
Inhibición de la hemaglutinación (HI)
- Detecta la presencia de anticuerpos.
- Tipo de muestra: suero.
- Pros:
- Los animales permanecen positivos durante varias semanas
- Puede utilizarse en casos crónicos
- Puede utilizarse para determinar el momento adecuado para la vacunación evitando la interferencia de anticuerpos maternales
- Puede utilizarse para determinar la protección cruzada entre cepas
- Contras:
- Cada prueba es específica de la cepa
- Requiere el aislamiento de la cepa específica para evaluar la protección cruzada
- Los animales tardan entre 10 y 14 días en volverse seropositivos
- No distingue entre vacunación e infección por virus campo
Interpretación de resultados:
Patología macroscópica
- Positivo: Confirmación de la presencia de neumonía.
- Negativo: Los casos tempranos pueden no manifestar lesiones pulmonares extensas.
Histopatología
- Positivo: Confirmación de la enfermedad.
- Negativo: Negativo o las lesiones no se detectan si se analiza una muestra incorrecta o se realiza mucho después de la infección.
IHC
- Positivo: El virus está presente en el sitio de la lesión.
- Negativo: Negativo o el virus no se detecta si la prueba se realiza mucho después de la infección o la concentración de virus es demasiado baja (sólo está presente por un corto período de tiempo).
Aislamiento del virus

- Positivo: Confirmación de la enfermedad.
- Negativo: El virus no se detecta si la prueba se realiza mucho después de la infección o simplemente no puede crecer debido a otra contaminación o una mala manipulación (presente pero muy difícil de cultivar).
PCR
- Positivo: Confirmación de la enfermedad.
- Negativo: Negativo, el virus no se detecta si la prueba se realiza mucho después de la infección o por una selección o manipulación incorrecta de la muestra.
- No concluyente: Muy poco virus presente o coinfección con más de un subtipo.
Secuenciación genética
- Permite identificar el subtipo y clado del virus.
- Permite ajustar la cepa vacunal para una mejor protección.
ELISA
- Positivo: Anticuerpos maternales o exposición anterior (> 2 semanas) a vacuna o virus campo.
- Negativo:
- Negativo a vacuna o virus campo
- Infección demasiado reciente para ser detectada (10-14 días para la seroconversión)
- Incompatibilidad entre la prueba y el virus (subtipo o clado)
HI
- Positivo: Anticuerpos maternales o exposición anterior (> 2 semanas) a vacuna o virus campo.
- Negativo:
- Negativo a vacuna o virus campo
- Infección demasiado reciente para ser detectada (10-14 días para la seroconversión)
- Incompatibilidad (subtipo o clado) entre el virus utilizado en la prueba y el virus que infecta al cerdo
Escenarios:
Cerdos de engorde con estornudos y signos respiratorios (agudos o crónicos):
- Recoge 2-4 muestras de fluidos orales del grupo y analízalas mediante PCR.
- Recoge 12 hisopos nasales de cerdos infectados con signos clínicos (tienen secreción nasal clara), haz 3 pools de 4 muestras cada uno y analízalos mediante PCR.
- Secuencia una muestra PCR positiva para determinar mejor el clúster/clado.
Determinación del momento de exposición y posible necesidad de vacunación:
- Recoge muestras de 10-15 cerdos a las 3, 6, 9 y 12 semanas de edad.
- Dos enfoques para la recogida:
- Transversal – recoge de diferentes grupos de edad a la vez (se obtienen resultados más rápido).
- Longitudinal – recoge de los mismos cerdos a lo largo del tiempo (se obtienen resultados más precisos).
- Análisis de muestras de suero mediante ELISA.
- Recoge 2-4 muestras de fluidos orales del grupo y analízalas mediante PCR.
- Secuencia una muestra PCR positiva de cada grupo de edad para determinar mejor el clúster/clado.



