Procesos fisiológicos de digestión de la proteína y producción de amoníaco en preiniciadores
Erick Castañón, Gonzalo Villar, Saúl Salgado, Alberto Butrón
Mito o Realidad
La inquietud por investigar la producción de amoníaco nace de la necesidad de los productores por conocer la presencia y concentración del gas dentro de sus instalaciones, es común en granjas tener la percepción de que las concentraciones del gas son altas. Sin embargo, esta puede ser una afirmación no muy bien fundamentada.
Actualmente se genera más información en el área de engorda, por lo que existe un periodo de menor estudio en el área de destete. La importancia de la presencia de este gas según sus concentraciones radica en que se asocia directa e indirectamente a diferentes patologías o trastornos, como problemas en el crecimiento de los animales, problemas respiratorios, conjuntivitis, retraso de la pubertad, canibalismo, etc. Con base en lo anterior, se observó un área de oportunidad y nace un servicio enfocado a conocer la presencia y concentración del amoníaco, en las diferentes áreas.
1. Fisiología Gastrointestinal
Una vez ingerido el alimento comienza el proceso de digestión de los alimentos con la masticación y salivación, posteriormente llega al estómago, donde se mezcla con las secreciones gástricas formando el quimo. El estómago consta de dos regiones fisiológicas; la región proximal que almacena el alimento y lo dispone en capas y la región distal que muele y filtra (Cunningham y Klein, 2003), con cada contracción de la región distal algo de alimento logra pasar el esfínter pilórico, aunque la mayor parte de alimento retrocede, (Guyton y Hall, 2009).
La motilidad del intestino delgado tiene dos fases, digestiva e interdigestiva, en la fase digestiva se conocen dos patrones de motilidad; propulsor y de segmentación (Guyton y Hall, 2009), interdigestiva, son fuertes contracciones, que propulsan el alimento no digerido y bacterias al intestino grueso como una forma de controlar la poblacion bacteriana, como una manera de controlar la población bacteriana (Cunningham y Klein, 2003).
Unas de las funciones del colon es el almacenamiento de las heces, fermentación de materia orgánica, la absorción y recuperación de electrolitos y agua, donde se extrae hasta el 90 % de este líquido (Ganong, 1994), para posteriormente ser expulsado en forma de heces.
Amoníaco
Su nombre deriva de una divinidad egipcia: Amón, los egipcios preparaban un compuesto, cloruro amónico, a partir de la orina de los animales en un templo dedicado a este Dios. Cuando se llevó a Europa mantuvo ese nombre en recuerdo de la sal de Amón (Ruiz et al., 2010).
Es una sustancia química encontrada de manera natural en el aire, suelo y agua, también es producido por seres humanos, animales y microorganismos como parte de procesos biológicos normales, aunque también es elaborada de manera industrial (Environmental Protection Agency, EPA, 2016). Esta agencia coloca al amoníaco en su lista de residuos peligrosos para la nación en el lugar 137 de 1647.
National Pork Board (2003), sugiere no sobrepasar las 50 ppm dentro de la sala, Renggaman et al., (2015), en su protocolo para evaluar el bienestar porcino, toman en cuenta la concentración de amoníaco dentro de las salas y la dividen en menos de 50 ppm y por encima.
2.Digestión y absorción de las proteínas
En el estómago el quimo se encuentra con un pH bajo, la pepsina y gastrina comienzan a actuar sobre el mismo, el páncreas juega un papel fundamental, produciendo una secreción acuosa rica en bicarbonato para neutralizar el pH proveniente del estómago (Cunningham y Klein, 2003). Las enzimas producidas en este órgano degradan las proteínas. Las enzimas proteolíticas más importantes son la tripsina, quimiotripsina y la carboxipolipeptidasa son secretadas en forma de zimógeno activadas en la luz del intestino mediante una enterocinasa (Guyton y Hall, 2009).
Las secreciones de las glándulas del intestino realizan la digestión en dos fases una luminal y una membranosa: la fase luminal; que se lleva a cabo en la porción medial del tubo digestivo provoca una hidrólisis en muchos casos incompleta de los nutrientes disminuyéndolos de sus moléculas originales. La mayoría de las enzimas que actúan en la fase luminal son endopeptidasas las cuales rompen las proteínas en puntos internos obteniendo péptidos de cadena corta y aminoácidos. Otras enzimas de la fase luminal, actúan en los bordes externos y se denominan exopeptidasas que pueden ser sintetizadas en estómago y páncreas (Cunningham y Klein, 2003). La fase membranosa se lleva a cabo en las paredes del intestino, en esta fase las peptidasas son secretadas en el borde de cepillo y reducen a las cadenas resultantes de la fase luminal a tripéptidos, dipéptidos y aminoácidos libres, son absorbidos al interior de la célula donde las peptidasas intracelulares terminan por hidrolizar estos enlaces resultando aminoácidos (Cunningham y Klein, 2003), los péptidos pueden ingresar a la célula mediante el cotransporte de sodio, pero algunos aminoácidos no usan este medio si no que son transportados por difusión facilitada por proteínas en la membrana (Guyton y Hall, 2009).
Una vez absorbidos los aminoácidos pasan a hígado vía porta antes de alcanzar la circulación sistémica, con excepción del glutamato que es desaminado prácticamente en su totalidad en intestino, mientras que su grupo amino es transferido al piruvato para formar alanina, lo mismo pasa para el aspartato, pero en menor medida, lo que hace que la alanina esté presente en altas concentraciones como se puede ver en la figura 1 (Cunningham y Klein, 2003).
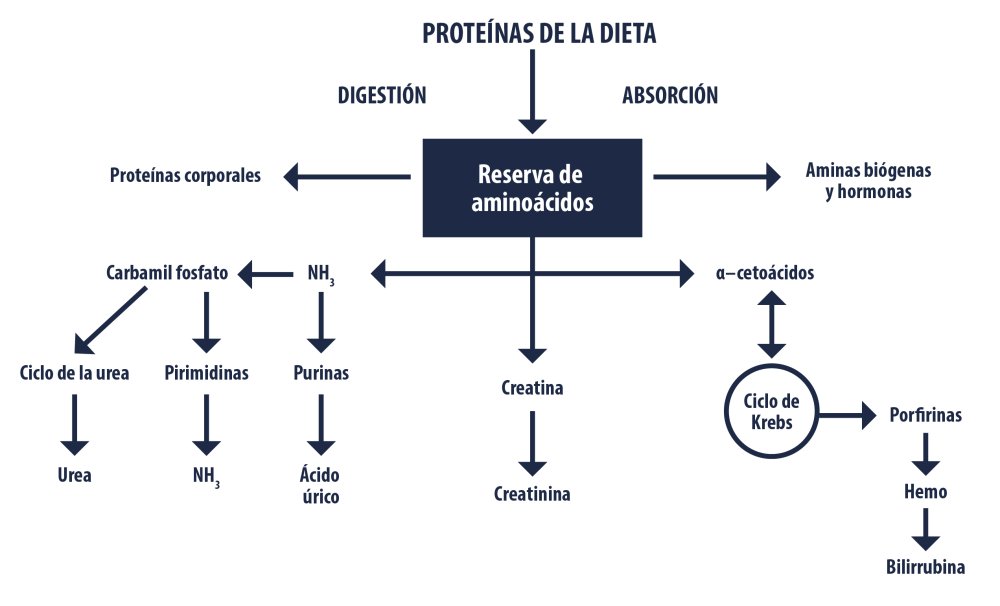
Metabolismo de las proteínas. Fuente: Montgomery et al. (1999)
Una vez en el hígado los aminoácidos son desaminados dando lugar a ceto-análogos los cuales son metabolizados para producir energía o síntesis de ácidos grasos, de los aminoácidos ingeridos entre el 14 al 20% son utilizados en el hígado para la síntesis de proteína hepática, solo un 23% pasa a circulación sistémica como aminoácidos libres para la síntesis de proteína no hepática y cerca de un 57% es convertido a urea y excretada por orina, y una pequeña parte se excreta como amonio (Cunningham y Klein, 2003).
3. Desarrollo microbiano en tracto digestivo
El tracto gastrointestinal de los fetos es estéril hasta el nacimiento, donde comienza el complejo proceso de colonización, con múltiples factores como la madre, el alimento y el medio ambiente, lo que da lugar a la flora bacteriana (Mackie et al., 1999). Swords et al., (1993), observaron que la colonización inicial del colon se da de manera súbita en las primeras 12 horas de vida del lechón, sugirieron dividir en tres fases la colonización del colon, la primera fase se da desde el nacimiento a los primeros siete días de edad, la segunda fase del día 7 al 21 o al término de la lactancia, la tercera fase comienza al momento del destete.
Todos los compuestos nitrogenados como las proteínas no degradadas en intestino delgado, restos celulares, nitrógeno, microrganismos, nitrógeno no proteico, amidas, amoniaco, nitratos, alcaloides, ácido úrico, vitaminas del grupo B, purinas, pirimidinas, etc., llegan al colon donde pueden ser utilizadas por las bacterias (Canudas, 2008).
4. Procesos fermentativos mediante la degradación microbiana.
La cantidad de nitrógeno fermentado en colon depende del total de proteína en la dieta y la digestibilidad de esta. La proteína de origen animal generalmente es más digestible que la proteína de plantas o leguminosas, a mayor cantidad de proteína proveniente de plantas mayor será la cantidad de nitrógeno en orina y en colon (Widney et al., 2012), por lo que está muy relacionado a la calidad de el alimento preiniciador.
La mayoría de las bacterias en colon prefieren utilizar los carbohidratos como fuente de energía, sin embargo, la proteína también es importante como sustrato, su degradación se da en varios pasos; la proteína es hidrolizada a oligopéptidos por Bacteroides spp mediante proteasas unidas a células, mientras que bacterias del género Clostridium, Propiomibacterium y Bacillus producen proteasas extracelulares, el Streptococcus y Staphylococcus fecales producen las dos formas de proteasas, obteniendo como resultado cadenas de carbón y nitrógeno (Blaut, 2011).
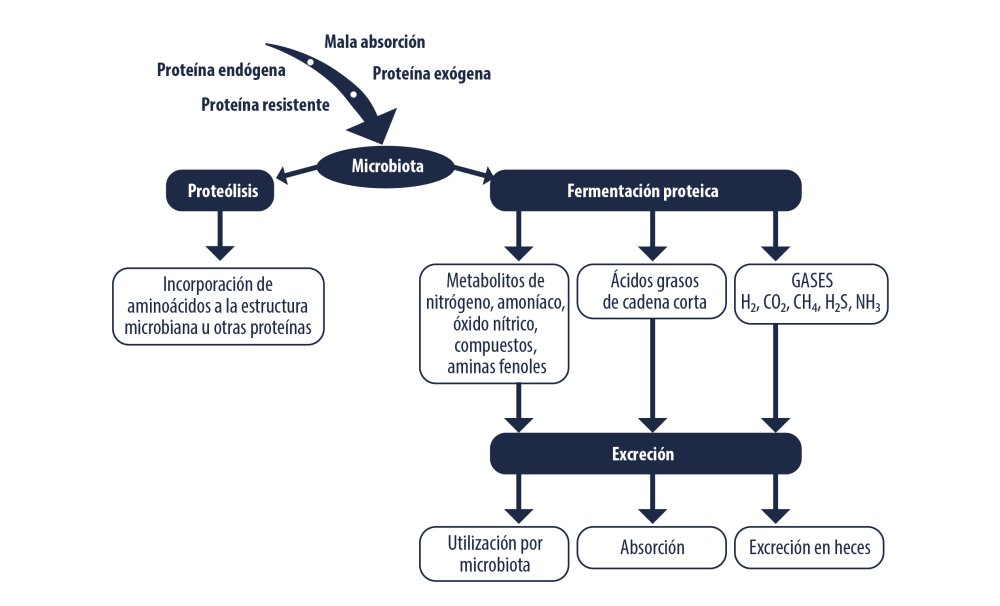
Destino de la proteína en intestino grueso. Fuente: Adaptado de Yao et al. (2015)
La degradación de proteína en colon se da por los microorganismos que incorporan pequeños péptidos y aminoácidos al interior celular para ser degradados hasta amoníaco (Owens et al., 1988), o para ser incorporados directamente a la síntesis de proteínas (Rotger y Ferret, 2004), también puede ser fermentada por los microorganismos generando gases como CO2, CH4, H2S y NH3 entre otros compuestos (Yao et al., 2015).
Los aminoácidos son metabolizados mediante transaminación, desaminación oxidativa, descarboxilación oxidativa, desaminación reductiva y reacción de Stickland, la velocidad de estas reacciones de aminoácidos hasta amoníaco es rápida por lo que su limitante es la disponibilidad del sustrato (Rotger y Ferret, 2004; Widney et al., 2012).
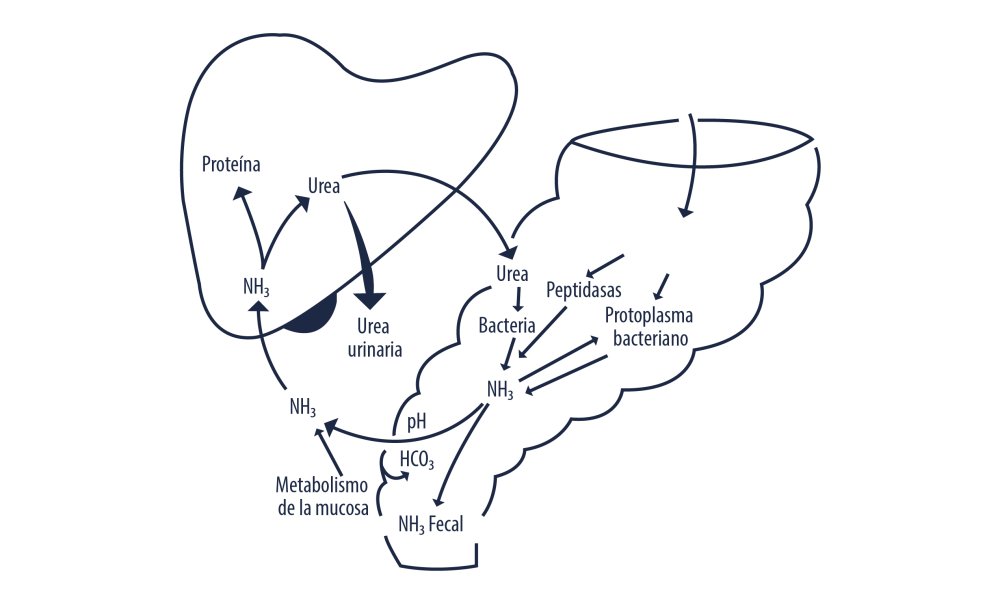
Origen y destino del amoníaco intestinal. Fuente: Wrong et al. (1984)
Parte del amoníaco producido en el intestino grueso es absorbido y trasportado al hígado vía porta, la mitad es convertido en urea para ser excretado por orina (Figura 2), el resto es transaminado para producir aminoácidos, otra parte es excretado como gas y compuestos nitrogenados, ver Figura 3 (Wrong et al., 1984). Las emisiones de amoníaco son el resultado de la degradación de nitrógeno existente en las excretas por microorganismos anaeróbicos, la urea excretada en orina es rápidamente convertida en NH3 mediante la enzima ureasa presente en heces, este proceso lleva unas pocas horas donde finalmente el amoníaco es volatizado (Figura 4). El nitrógeno presente en heces tiene un proceso más lento, al igual que en el intestino grueso, una parte del nitrógeno es utilizado por las bacterias y degradado para formar NH3, H2S y óxido nítrico (Fernandes et al., 2015).
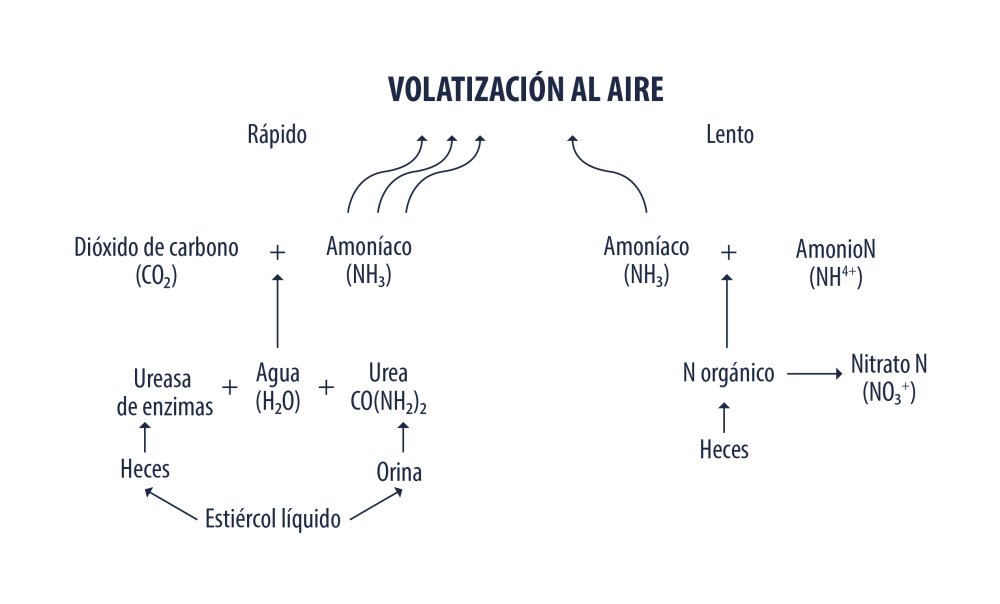
Proceso de volatización del amoníaco de heces. Fuente: Fernandes et al., (2015)
5. Generalidades del amoníaco
Molécula compuesta por un átomo de nitrógeno (N) y tres átomos de hidrógeno (H) y cuya fórmula química es NH3, es un gas incoloro, tóxico, de olor penetrante e irritante, más ligero que el aire, puede ser comprimido y convertido a líquido bajo presión, encontrado de forma normal en el aire a 0.0006 ppm, el olor a amoníaco es conocido porque se utiliza en las sales aromáticas y productos de limpieza (ATSDR, 2004).
El amoníaco reacciona con el agua para por formar ion amonio (NH3 + H20 NH4+ + OH-). Cuando el pH disminuye aumenta la concentración de NH4+, por lo que en el organismo lo encontramos de esa manera (EPA, 2016).
6. Algunos efectos del amoníaco
Drummond et al., (1980), estudiaron los efectos de concentraciones graduales de amoníaco en cerdos de 8.4 kg, con concentraciones de 0, 50, 100 y 150 ppm durante cuatro semanas de manera continua, con una temperatura de 24°C, se observó una disminución del crecimiento de los cerdos en 12, 30, 29% respectivamente para cada concentración, además se observó una reacción inflamatoria aguda y exudado leve en los cerdos expuestos a 100 y 150 ppm, no así para el grupo control y 50 ppm, Aarnink et al., (1996) midieron las la emisiones de amoníaco durante el día, encontrando que los cerdos orinan con mayor frecuencia entre las 15 y 18 h lo que aumenta la concentración del gas en el medio ambiente.
Drummond et al., (1981), realizaron un estudio en cerdos de 8 kg con cuatro tratamientos, en el primero inocularon Bordetella, en el segundo inocularon Bordetella más la exposición al amoníaco a 50 ppm, en el tercero inocularon Bordetella más exposición al amoníaco 100 ppm y cuarto como grupo control, el resultado fue el decrecimiento en la ganancia de peso en los cerdos con Bordetella vs. el grupo control en un 26% independientemente de la concentración de amoníaco, los cerdos en un ambiente con amoníaco presentaron rinitis, relacionada a la presencia del gas.
Koerkamp et al., (1998), realizaron un estudio para conocer las concentraciones de amoníaco en cuatro países en el norte de Europa en cerdos de destete encontrando concentraciones promedios que oscilaron entre las 3.7 y 7.8 ppm con una lectura máxima de 36.7 ppm, en un estudio realizado en México con lechones alimentados con una dieta especializada, se obtuvo un promedio de 0.82 ppm, así como una mayor concentración durante el día Vs noche (1.59 Vs 0.20 ppm) respectivamente, con una concentración de 14.02 ppm a las 15h. (Castañón, 2018).
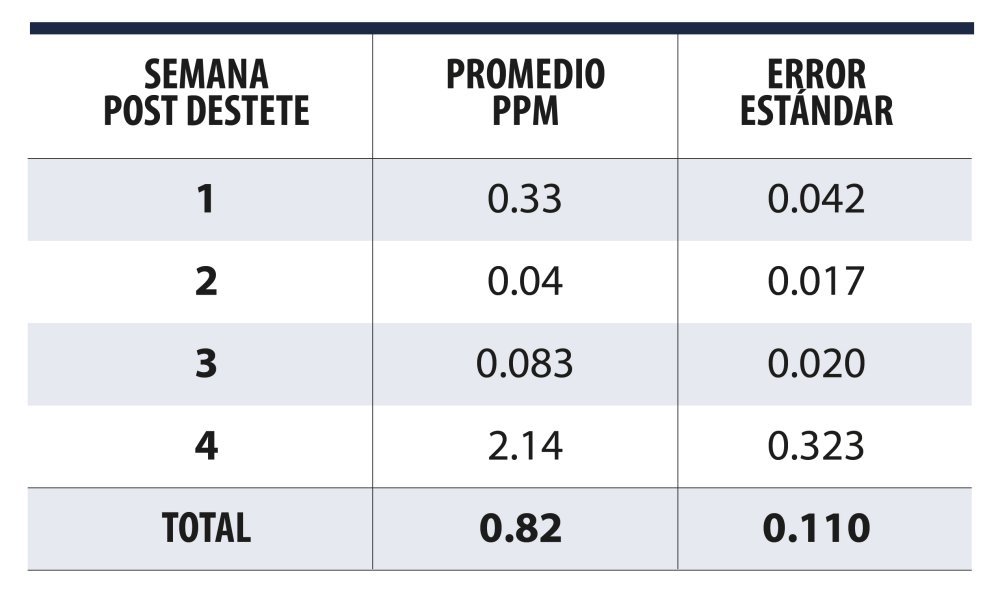
Concentraciones semanales de NH3
Philippe et al., (2011), señalan que a partir de la firma de 51 países en la convención de la contaminación transfronteriza de largo alcance (Griffing et al, 2007), Europa logró disminuir la producción de amoníaco en un 24% de 1990 a 2008, aun cuando su producción aumentó en 19%, ellos relacionan esta disminución, a dietas mejor balanceadas en cuanto al contenido de proteína cruda, la suplementación con sales acidificantes, el uso de otros aditivos como extracto de yuca, zeolitas, probióticos, sustancia húmica o lactosa lo que conlleva también a una mayor eficiencia de la alimentación.
El amoníaco puede llegar a ser fatal en humanos a partir de 5,000 ppm en tan solo 30 min, pero puede causar daño a la salud desde las 50 ppm, irritando los ojos y las vías respiratorias en tan solo 5 min (ATSDR, 2004).
7. Conclusiones
La producción del amoníaco está ligada al tipo de compuestos nitrogenados de la dieta, las dietas de preiniciadores son altamente digestibles, el utilizar materias primas de alta calidad, aminoácidos sintéticos y aditivos ayudan a un mayor aprovechamiento de los nutrientes y una menor producción de amoníaco. Existe producción de amoníaco durante las primeras cuatro semanas postdestete frecuentemente con resultados por debajo de los recomendados, sin embargo, en altas concentraciones el gas en el ambiente se puede asociar a baja ganancia de peso, irritación de mucosas y problemas respiratorios. Es difícil conocer la cantidad de gas presente dentro de las salas debido a que es necesario contar con equipo especializado, sin embargo, es de suma importancia conocer la presencia y concentración del gas durante todo el desarrollo de los cerdos.
8. Bibliografía
- Aarnink, A. J. A., Van den Berg, A. J., Keen, A., Hoeksma, P., Verstegen, M. W. A. 1996. Effect of slatted floor area on ammonia emission and on the excretory and lying behaviour of growing pigs. Journal of Agricultural Engineering Research, 64(4), 299-310.
- Agency for Toxic Substances and Disease Registry (ATSDR). 2004. Toxicological profile for ammonia. Recuperado a partir: https://www.atsdr.cdc.gov/toxprofiles/tp126.pdf, consultado el 26 de julio 2017.
- Blaut, M. 2011. Ecology and physiology of the intestinal tract. In Between Pathogenicity and Commensalism (pp. 247-272). Springer, Berlin, Heidelberg.
- Canudas, M. R. I. 2008. Tesis doctoral. Estudio del ecosistema bacteriano del tracto digestivo del cerdo mediante técnicas moleculares. Tesis doctoral. Universidad Autónoma de Barcelona, Barcelona, España.
- Cunningham GJ, Klein BG. Fisiología Veterinaria. 3 ed. Barcelona, España: Elsevier, 2003. Pp 222-322
- Drummond, J. G., Curtis, S. E., Simon, J., Norton, H. W. 1980. Effects of Aerial Ammonia on Growth and Health of Young Pigs 1. Journal of Animal Science, 50(6), 1085-1091.
- Environmental Protection Agency (EPA). 2016. Toxicological Review of Ammonia Noncancer Inhalation: Executive Summary. Recuperado a partir: https://www.epa.gov/iris, consultado el 26 de julio 2017.
- Environmental Protection Agency (EPA). 2016. Toxicological Review of Ammonia Noncancer Inhalation: Executive Summary. Recuperado a partir: https://www.epa.gov/iris, consultado el 26 de julio 2017.
- Fernández, G. 2014. Fundamentos de química orgánica. Recuperado a partir: http://www.quimicaorganica.net/libro-fundamentos-de-quimica-organica.html Consultado el 3 de abril de 2017.
- Ganong FW. Fisiología Médica. 14 ed. México, D.F.-Santafé Bogotá: El manual moderno. 1994.
- Griffing, E. M., Overcash, M., Westerman, P. 2007. A review of gaseous ammonia emissions from slurry pits in pig production systems. Biosystems engineering, 97(3), 295-312
- Guyton CA, Hall JE. Tratado de Fisiología Médica. 10 ed. México: McGraw Interamericana, 2009.
- Koerkamp, P. G., Metz, J. H. M., Uenk, G. H., Phillips, V. R., Holden, M. R., Sneath, R. W., Schröder, M. 1998. Concentrations and emissions of ammonia in livestock buildings in Northern Europe. Journal of Agricultural Engineering Research, 70(1), 79-95.
- McKee, T., McKee J. Bioquímica. La base molecular de la vida. McGraw-Hill Interamericana. 2003. 3 ed. España
- Montgomery, R., Conway, T., Spector, A., Chappell, D. 1999. Bioquímica casos y texto. Harcourt Brace. 6 ed. España.
- National Pork Board, 2003. Pork Checkoff, Swine Welfare Assurance Program, a Program of America's Pork Producers. Des Moines.Veterinaria, 11(3B).
- Owens, F., N., Zinn, R., y Church, D. 1988. Metabolismo de la proteína en los rumiantes. El rumiante: fisiología digestiva y nutrición. Zaragoza: Acribia, 255-282.
- Philippe, F. X., Cabaraux, J. F., Nicks, B. 2011. Ammonia emissions from pig houses: Influencing factors and mitigation techniques. Agriculture, ecosystems & environment, 141(3-4), 245-260.
- Renggaman, A., Choi, H. L., Sudiarto, S. I., lasaarela, L., Nam, O. S. 2015. Development of pig welfare assessment protocol integrating animal-, environment-, and management-based measures. Journal of animal science and technology, 57(1), 1.
- Rotger, A. C., Ferret, A. Q. 2004. Fermentación ruminal, degradación proteica y sincronización energía proteína en terneras en cebo intensivo. Tesis doctoral. Universidad Autónoma de Barcelona, Barcelona, España.
- Ruiz Perdomo, J. C., Milán Cárdenas, M. D. C., Murguía Cruz, B. 2010. Folleto sobre seguridad y uso del amoniaco. REDVET. R •
- Swords, W. E., Wu, C. C., Champlin, F. R., Buddington, R. K. 1993. Postnatal changes in selected bacterial groups of the pig colonic microflora. Neonatology, 63(3), 191-200.
- Windey, K., De Preter, V., Verbeke, K. 2012. Relevance of protein fermentation to gut health. Molecular nutrition & food research, 56(1), 184-196.
- Wrong, O. M., Vince, A. 1984. Urea and ammonia metabolism in the human large intestine. Proceedings of the Nutrition Society, 43(1), 77-86.
- Yao, C. K., Muir, J. G., Gibson, P. R. 2016. insights into colonic protein fermentation, its modulation and potential health implications. Alimentary pharmacology & therapeutics, 43(2), 181-196
Contacto:
Contacta con nosotros a través del siguiente formulario.


