Caso clínico: mejorando el control del PRRS mediante el control de los procesos digestivos
15-may-2023 (hace 2 años 9 meses 18 días)
La aparición de nuevas cepas de virus PRRS junto con las limitaciones del uso de antibióticos, están haciendo que cambien los paradigmas en la producción porcina. Es un hecho que, en España a nivel global, las bajas de animales entre las fases de destete y cebo se han incrementado en un 4%, debido a un aumento de los problemas sanitarios. Cada día, conocemos más herramientas para el control de muchas de las patologías que afectan a las granjas, pero debemos realizar un abordaje distinto a los problemas de siempre y en esto radica el trabajo del veterinario de producción: en saber cambiar. Para ello, tenemos que apoyarnos tanto en las nuevas investigaciones (libros, artículos científicos, etc.) como en los propios animales.
Actualmente, está bastante documentado que la microbiota intestinal influye claramente en la modulación de las respuestas inflamatorias y, que, por lo tanto, cualquier enfermedad digestiva que dé lugar a cambios en la microbiota, origina posiblemente, una reducción de los macrófagos alveolares y un cambio en la respuesta inmunológica Th1 y Th2 (Leucocitos T Helper). Como consecuencia, se puede producir un incremento en la respuesta inflamatoria a nivel pulmonar y también un incremento de las recidivas y persistencia de las enfermedades pulmonares.
Caso clínico
Nos encontramos con una granja de unas 2000 reproductoras situada en la Región de Murcia. Al tratarse de una finca que tiene una extensión de unas 100 hectáreas aproximadamente, las distintas fases de producción se encuentran alejadas. Las reproductoras están en un núcleo, a 1 km de distancia se localizan los destetes y las cebas están distribuidos a unos 3 km de las reproductoras.
La granja de reproductoras es positiva al virus PRRS y actualmente estable al mismo. Cuenta con un plan mensual de monitorización con muestreo de lenguas de nacidos muertos, diferenciando entre lechones de multíparas y primíparas. Dicha monitorización consiste en la determinación de PCR frente a PRRS y PCV-2, con el objetivo de tener controlados ambos virus en la granja. Durante este periodo, las analíticas de lenguas de nacidos muertos resultaron ser negativas a PRRS y PCV-2. Cuando un muestreo sale positivo al virus PRRS, efectuamos la secuenciación por ORF5 para comprobar si se trata de cepa nueva procedente de una entrada lateral del virus y por lo tanto hay fallos en la bioseguridad externa.
La granja es positiva a Brachyspira hyodysenteriae pero, mediante el uso de autovacunas, la clínica está controlada y no se observa sintomatología ni en las cerdas en producción ni en las futuras reproductoras, las cuales tienen incluida en su programa vacunal dicha autovacuna. Este proceso se considera controlado, aunque puntualmente aparece sintomatología compatible con Disentería porcina en los engordes cuando se encuentran aproximadamente en los 50-80 kg de peso, coincidiendo con una pérdida de la inmunidad adquirida a través de las madres.
En la ceba se observa cierto grado de mordedura de rabos que para nosotros es un indicador de la presencia de disentería aún en los casos que no observamos una clínica compatible de una manera clara. Si los cerdos tienen la enfermedad de forma subclínica y, por lo tanto, una inflamación del colon, suelen estar más nerviosos y mueven el rabo con insistencia. Como sabemos, esto es un imán para los compañeros que empezarán a morderse unos a otros. Una vez se establece el comportamiento anómalo es difícil de controlar, ya que la inflamación crónica induce un comportamiento similar a la ansiedad.
Inicio del problema
Los animales se trasladan a cebaderos de 6000 plazas que se llenan a lo largo de 4 semanas consecutivas. Al mes de la entrada de los animales, comienza un proceso respiratorio con fuerte disnea y anorexia. Se decide administrar un tratamiento antibiótico con florfenicol soluble en agua de bebida (el primer día asociado con un antiinflamatorio para aumentar el consumo de agua), pero tras el tratamiento implementado, las bajas continúan y no se produce ninguna mejora de los animales. Se mandan al laboratorio pulmones de animales muertos que presentan grandes áreas de consolidación pulmonar. Se opta por administrar un tratamiento antibiótico inyectable de Marbofloxacina a todos los cerdos (por una parte, para tener la seguridad de que cada animal recibe la dosis adecuada y por otra, para poder llegar al pulmón con una concentración de antibiótico efectiva). A pesar de apreciarse una mejoría en el estado general de los animales, a las dos semanas se observa una recaída y seguimos sin poder controlar las bajas que se producen. La clínica vuelve con la misma intensidad y sigue generando un gran número de bajas (Foto 2 y 3).

 Se envían al laboratorio muestras de pulmones procedentes de las bajas producidas y se solicita PCR de PRRS, PCV-2 e Influenza A. Todas las muestras resultaron ser negativas a PCV-2 e Influenza A y positivas al virus PRRS, con lo que se procedió a la secuenciación del virus por ORF5 para ver si había entrado una cepa de alta virulencia en la explotación que nos explicara la gravedad de los síntomas clínicos.
Se envían al laboratorio muestras de pulmones procedentes de las bajas producidas y se solicita PCR de PRRS, PCV-2 e Influenza A. Todas las muestras resultaron ser negativas a PCV-2 e Influenza A y positivas al virus PRRS, con lo que se procedió a la secuenciación del virus por ORF5 para ver si había entrado una cepa de alta virulencia en la explotación que nos explicara la gravedad de los síntomas clínicos.
Cuadro 1. Analíticas de muestras de pulmón y fluidos orales tomadas en el cebo.
| Fecha | Cebadero | Muestra | PRRSv | PCV-2 | Influenza tipo A |
|---|---|---|---|---|---|
| Nov-22 | A | Pulmón | PRRSv (Ct 28) | - | - |
| Nov-22 | B | Pulmón | PRSSv (Ct 20) | - | - |
| Nov-22 | C | Fluidos orales | PRRSv (Ct 30) | - | - |
| Nov-22 | D | Fluidos orales | PRRSv (Ct 36) | - | - |
Aunque nos surgía una duda muy importante: lo normal es que un patógeno de nueva introducción, si tiene una baja prevalencia, produzca clínica al final del periodo de ceba y conforme incrementa su prevalencia lo haga en animales cada vez más jóvenes. Sin embargo, esto no es lo que ocurría en esta pirámide, por lo que pensamos que los tratamientos antibióticos reducirían el impacto de la enfermedad, pero no es lo que ocurrió.
En el momento que se obtuvo la secuenciación del virus PRRS, se comprobó que era la misma cepa ya que había una homología filogenética con la cepa residente de esa pirámide. Sin embargo, en la fase de ceba no se había comportado de esta manera nunca. Anteriormente, aparecía sintomatología respiratoria pero muy fácilmente controlable con tratamiento antibiótico (florfenicol).
¿Qué estaba ocurriendo en la línea de ceba para este comportamiento anormal?
En este momento se plantea una nueva forma de abordar la infección, ya que cada día hay un mayor conocimiento del Eje Intestino-Pulmón, y se sabe que lo que ocurre en el intestino afecta a la gravedad de los procesos respiratorios.
Se planteó si había alguna otra patología que no fuera pulmonar, sino que se localizara en el intestino y aislamos Brachyspira hyodesenteriae en heces. Este hallazgo no era nuevo, pero pensábamos que estaba controlada ya que no aparecía la sintomatología clásica de diarrea mucohemorrágica si no que solo se apreciaba un blandeo que aparentemente no parecía tener demasiada importancia clínica.
¿Podía la presencia de Brachyspira hyodesenteriae ser una de las causas de la gravedad y persistencia de los síntomas clínicos?
HIPOTESIS: “La presencia de Brachyspira hyodesenteriae y su impacto en la microbiota intestinal podría estar afectando a la modulación de las respuestas inflamatorias con un incremento en la respuesta inflamatoria a nivel pulmonar, y una reducción de los macrófagos alveolares lo que estaría creando un ambiente inmunitario en el cual no era posible eliminar con la suficiente eficacia el virus PRRS y también favorecería un incremento de las recidivas y persistencia de las enfermedades pulmonares”.
Se procedió a comprobar que la cepa de Brachyspira hyodesenteriae aislada seguía siendo la cepa residente y conocer las CMI para los distintos antibióticos que debíamos usar para su control.
Cuadro 2. CMI de los distintos antibióticos para la cepa de Brachyspira hyodesenteriae aislada.
| CEPA SV22-3448 | |||||
|---|---|---|---|---|---|
| Antibiótico rango analizado (μg/ml) |
CMI (μg/ml) |
Interpretación sensibilidad | Rango (μg/ml) | ||
| Tiamulina (0,063 - 8) | 0,5 | Intermedia |
≤ 0,25 > 0,25 - ≤ 2 > 2 |
Sensible Intermedia Resistente |
La et al., 2016 |
| Valnemulina (0,031 - 4) | < 0,031 | Sensible |
≤ 0,25 > 0,25 - ≤ 2 > 2 |
Sensible Intermedia Resistente |
La et al., 2016 |
| Tilvalosina (0,25 - 32) | 8 | Intermedia |
≤ 0,25 - < 1,5 > 1,5 - ≤ 36 > 36 |
Sensible Intermedia Resistente |
Pringle et al., 2012 |
| Lincomicina (0,5 - 64) | 32 | Intermedia |
≤ 4 > 4 - ≤ 36 > 36 |
Sensible Intermedia Resistente |
Kirchgässner et al., 2016 |
| Tilosina (2 - 128) | > 128 | Resistente |
≤ 1 > 1 - ≤ 4 > 4 |
Sensible Intermedia Resistente |
La et al., 2016 |
Como vemos en el cuadro 2, la tiamulina aparecía como la mejor opción, pero a nivel de campo y con las características físicas del agua de la Región de Murcia (calidad pobre y mucha salinidad), no se obtiene una buena eficacia con este antibiótico, siendo la lincomicina el principio activo que nos ofrece mayor cobertura para una mejor resolución del problema clínico. Se procedió a instaurar un tratamiento antibiótico enfocado prioritariamente en el control de la Disentería Porcina a nivel subclínico.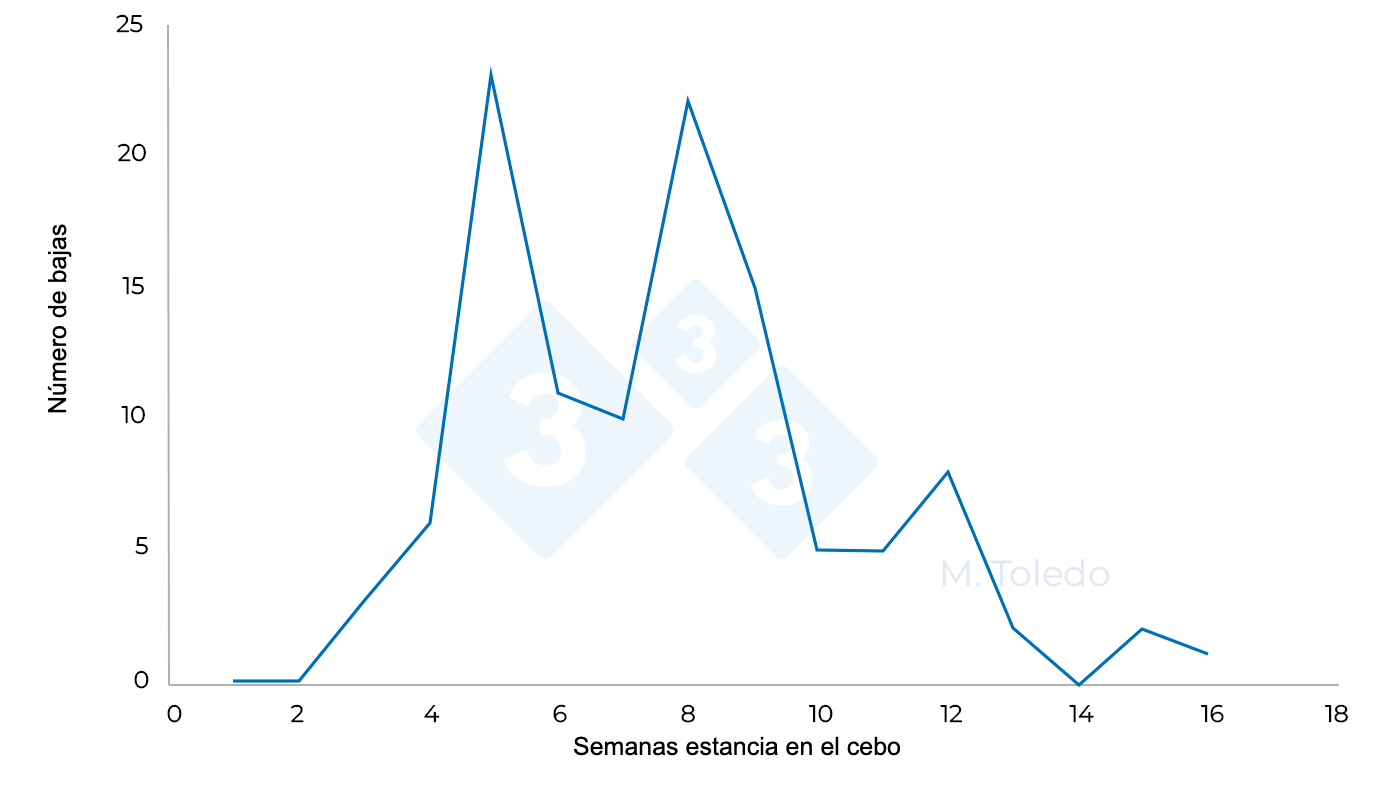
Conclusión
El éxito en el abordaje de este caso clínico, radicó en controlar la disentería, aunque la encontrásemos de manera subclínica. Se consiguió de esta manera, que el proceso respiratorio cursase de una manera mucho menos agresiva y sin recidivas. El control de la disentería, también dio lugar a una reducción en la aparición de nuevos episodios de mordedura de rabos.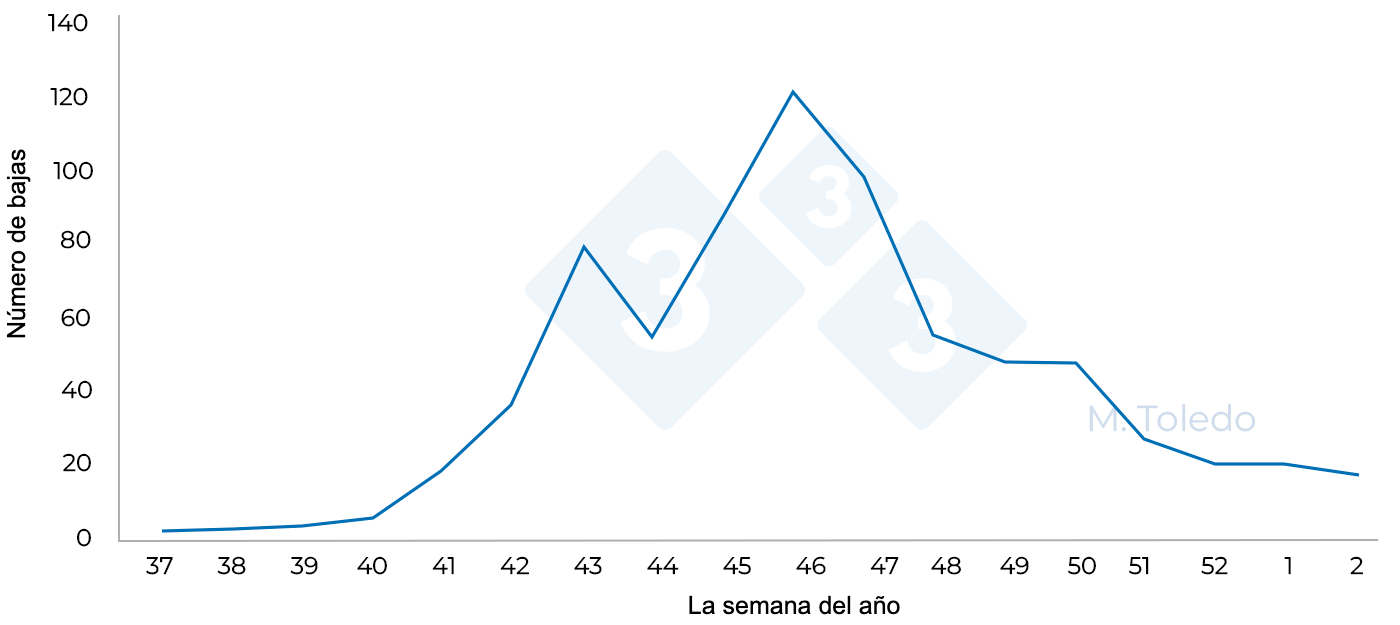
Debemos empezar a realizar abordajes distintos de los procesos respiratorios (sobre todo el que nos está generando más problemas, que es el virus PRRS), efectuando una monitorización y control de los cuadros entéricos que aparecen por las interacciones entre los distintos patógenos intestinales que son capaces de producir disbiosis. Es importante no considerar a estos patógenos digestivos de manera individual ya que se establecen muchas interacciones entre ellos (Brachyspira spp, Lawsonia intracellularis, Escherichia coli, etc). Esta alteración del intestino puede estar modulando la intensidad y la duración de los procesos respiratorios y, por tanto, complicando el control de los mismos.
