Optimización de la inseminación post-cervical en la especie porcina: puntos críticos
16-feb-2016 (hace 10 años 7 días)
Aunque la inseminación post-cervical (PCAI) es una técnica de reciente implantación, su descubrimiento data del año 1959 donde J.L. Hancock describe por primera vez la aplicación de esta metodología en la especie porcina. Esta técnica quedó en el olvido hasta hace relativamente pocos años donde comenzó su implantación a nivel de granja hasta la actualidad. A pesar de que su uso está muy extendido a nivel mundial y es una tecnología reproductiva relativamente fácil de aplicar, no debemos de olvidar algunos puntos críticos a considerar para maximizar su eficiencia. En primer lugar, debemos tener en cuenta que hasta el momento, la aplicación de la técnica debe realizarse en aquellas hembras reproductoras que han tenido al menos un parto. El estado de celo de esas hembras debe ser óptimo (Figura 1A), y para ello debemos considerar la fisiología reproductiva de la hembra, ya que la máxima abertura del cérvix se produce en la fase de celo próxima a la ovulación, momento en el cual la cánula interna pueda atravesar el cérvix sin dificultad hasta llegar al cuerpo del útero.
Por otro lado, el macho recela estará presente durante el diagnóstico de celo (Figura 1A), pero no durante el momento de la inseminación, reduciendo así las contracciones del cérvix, lo que lo que facilita la introducción de la cánula interna. Se recomienda un período de espera entre la detección del celo y la inseminación.
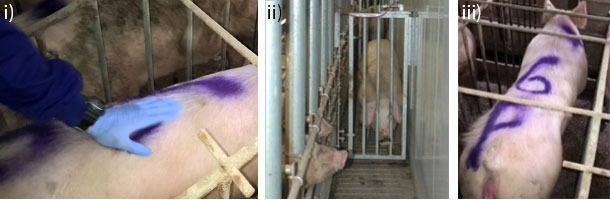
Figura 1. A) Celo: i) Procedemos a la detección del celo observando la reacción de la cerda ante el operario mediante la presión ejercida por éste en la parte dorsal de la hembra, y (ii) la presencia del macho recela. iii) Observaremos como la cerda presenta diferentes síntomas de celo como son el reflejo de inmovilidad y orejas erguidas, además de un estado edematoso y enrojecido de la vulva.
La higiene es otro factor importante a tener en cuenta durante la PCAI (Figura 1B). Mediante la PCAI estamos entrando a un lugar de inseminación “no fisiológico”, ya que el pene del verraco y el útero están diseñados para que la deposición del semen sea a nivel cervical, actuando el cuello uterino como una barrera para evitar el paso de microorganismos al interior del útero. Por tanto, es recomendable hacer una limpieza exhaustiva de la vulva para evitar arrastrar partículas y microorganismos al interior del tracto genital de la hembra durante la introducción del dispositivo de inseminación.
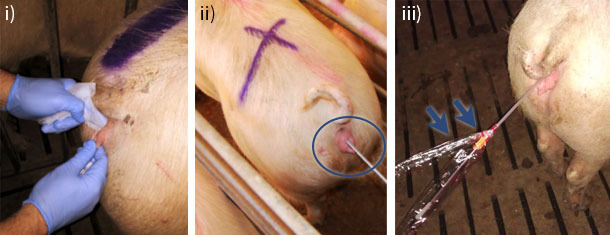
Figura 1. B) Higiene: i-ii) La vulva debe de estar limpia antes de proceder a la inseminación, por lo que se recomienda el uso de toallitas húmedas realizando siempre la limpieza del interior al exterior de la vulva. iii) Conservar el envoltorio del catéter puede evitar ensuciar el dispositivo de inseminación aumentando la higiene.
Una vez tenemos la hembra preparada procedemos a la introducción del catéter cervical, esperando 1-2 min a que la cerda relaje el cérvix y proceder a la inserción de la cánula interna sin dificultad. Al introducir la cánula en el interior de la hembra, debemos asegurarnos de que la disposición del equipo de inseminación es adecuada (Figura 2A). Para ello, empujamos el conjunto catéter-cánula en dirección craneal. Si la cánula no retrocede respecto al catéter, nos indica que se encuentra bien posicionada.
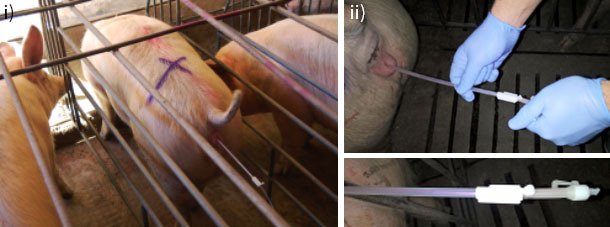
Figura 2. A) Dispositivo de inseminación: i) Tras la introducción en primer lugar del catéter cervical debemos dejar un tiempo para la relajación del cérvix. ii) Transcurridos unos minutos la cánula interna puede introducirse de manera completa y sin dificultad. Una vez el dispositivo catéter/cánula se encuentre posicionado correctamente procedemos a introducir el semen de manera rápida para su correcta distribución por el útero de la cerda.

Figura 2. B) Reflujo: i-ii) El reflujo no debe aparecer (o ser muy escaso) durante la PCAI, sin embargo tras la inseminación es normal la salida de semen por la vulva. El reflujo puede ser recolectado, para su posterior análisis, mediante el uso de bolsas adheridas alrededor de la vulva.

Figura 2. C) Fin de la inseminación: i) Retiramos la cánula de manera inmediata. ii) Comprobamos la curvatura característica (que no pliegues) de la cánula interna tras su recorrido por el cérvix.
Una vez el catéter-cánula se encuentra situado de manera adecuada estamos en disposición de introducir la dosis seminal, de la que tenemos que tener en cuenta diversos aspectos. Se ha comprobado que el uso de dosis seminales en PCAI con una concentración espermática entre 1000-2000x106 en un volumen de 26-60 ml se obtienen unos resultados similares a la inseminación cervical tradicional (3000x106 de espermatozoides/80-100 ml). El uso de dosis con mayor o menor concentración espermática en PCAI dependerá de otros muchos factores que podrían ser objeto de otro artículo. Por otro lado, es importante considerar la calidad espermática, ya que al utilizar un menor número de espermatozoides cualquier merma en su calidad puede tener graves consecuencias en las tasas de fertilidad y prolificidad. La dosis de inseminación tiene que ser introducida de manera rápida para su distribución a través de los cuernos uterinos. No debe haber reflujo durante el proceso de PCAI (aunque sí es habitual en los minutos posteriores a la inseminación — Figura 2B). Si observamos reflujo a través de la vulva o del catéter/cánula, puede significar que el cérvix no esté del todo relajado por lo que esperamos algunos minutos antes de repetir el proceso. Otra posible causa es que la inseminación sea muy temprana (al inicio del celo) o muy tardía (al final del celo), con lo que el cérvix no estaría totalmente abierto. Una vez depositada la dosis seminal debemos retirar la cánula de inmediato para interrumpir la conexión del útero con el exterior y de esta forma evitar entrada de patógenos. Es conveniente al retirar la cánula interna comprobar que la curvatura que presenta corresponda con la forma anatómica del cérvix y sin pliegues (Figura 2C), indicando que la inseminación ha sido realizada de manera correcta. Si encontramos cierta dificultad en introducir la cánula es importante no forzar su penetración ya que podemos provocar lesiones en la mucosa uterina y en consecuencia observar la presencia de sangre al retirar el dispositivo de inseminación. Aun así, los parámetros reproductivos pueden llegar a ser muy similares entre las hembras en ausencia o presencia de sangre (no abundante) durante la inseminación, aunque por supuesto no es la situación ideal.
Con todo lo descrito, debemos analizar de manera ordenada cada uno de los peligros y puntos críticos de control de cada uno de los factores anteriormente mencionados (Tabla 1), ya que pequeños errores en alguno de los factores mencionados pueden hacer que el resultado final de la aplicación de esta técnica no sea el esperado.
Tabla 1. Lista de verificación de factores a tener en cuenta durante una inseminación post-cervical: puntos críticos de control.
| Puntos críticos | Descripción | Referencias | |||
| 1. Tipo de hembra | Multíparas y primíparas. | Watson y Behan, 2002 Diehl et al. 2006 Hernández-Caravaca et al. 2012 Sbardella et al. 2014 |
|||
| 2. Celo | Estado óptimo de celo-máxima apertura del cérvix. | Rigby, 1967 | |||
| 3. Macho recela | Detección de celo y estimulación uterina. No presente durante inseminación post-cervical. |
Langendijk et al. 2005 | |||
| 4. Higiene | Limpieza exhaustiva de la vulva. | Araujo et al. 2009 García-Vázquez et al. 2015 Hernández-Caravaca et al. 2015 |
|||
| 5. Dispositivo | Disposición catéter/cánula adecuado. | Watson y Behan, 2002 | |||
| 6. Dosis seminal | Concentración y volumen. Calidad espermática. | García-Vázquez et al. 2015 Hernández-Caravaca et al. 2012 y 2015 |
|||
| 7. Reflujo | No debe aparecer (o ser escaso) durante la inseminación post-cervical. Sí es frecuente tras la inseminación. | Steverink et al. 1998 Dallanora et al. 2004 Mezalira et al. 2005 Hernández-Caravaca et al. 2012 |
|||
| 8. Sangre | No forzar la entrada de la cánula interna para evitar lesiones. | Serret et al. 2005 Sbardella et al. 2014 |
|||
