Streptococcus suis: ¿es posible la intervención nutricional?
08-jun-2021 (hace 4 años 8 meses 27 días)
Las infecciones por estreptococos en cerdos son un problema endémico causado por Streptococcus suis (S. suis), principalmente identificado por signos clínicos neurológicos asociados con meningitis, artritis y mortalidad post-destete (Lun et al., 2007; Goyette-Desjardins et al., 2014). La enfermedad está relacionada con la colonización de las tonsilas y el tracto respiratorio (Gottschalk y Segura, 2019), aunque también se ha descrito como posible la vía de infección gastrointestinal (Swildens, 2009). No obstante, esta última vía de infección está en discusión, ya que el pH del estómago es una barrera importante para los modelos orales de S. suis y todavía no se han identificado las condiciones que permiten el paso del estómago (Warneboldt et al., 2016).
Si bien se conoce mucho sobre la enfermedad, sigue faltando un modelo repetible que imite una infección natural. Citando a Segura et al. (2016), “las primeras etapas de la patogenia de la infección por S. suis han sido un área de investigación olvidada”. Además, S. suis persiste en la indústria porcina y continúan faltando vacunas. Las bacterinas autógenas son la única opción disponible, pero los resultados son contradictorios. La vacunación de lechones de cerdas inmunizadas probablemente no ofrece protección debido a la interferencia de los anticuerpos maternales (Baums et al., 2010). Por otro lado, la inmunidad maternal pasiva puede proteger a la descendencia (Rieckmann et al., 2020). No obstante, la evidencia indica que la eliminación de anticuerpos maternales contra S. suis tiene lugar antes del destete, independientemente del origen de la cerda vacunada o portadora (Corsault et al., 2021).
Si preguntamos a los ganaderos sobre la incidencia de S. suis, una respuesta común es “tenemos algunos casos en cada lote y, de vez en cuando, algún brote”. Asimismo, existe una creciente preocupación que las restricciones en el uso de antimicrobianos puedan agravar la situación. Se hizo un esfuerzo para recopilar la experiencia de los veterinarios de campo y la evidenceia de investigaciones publicadas sobre los riesgos de la enfermedad, lo que generó una lista de preguntas empíricas. El resultado se resume con una hipótesis similar a una ecuación con los factores potenciales que contribuyen a reducir o aumentar el riesgo de enfermedad (figura 1).
Figura 1. Hipótesis en forma de ecuación para describir algunos factores potenciales que contribuyen a reducir o aumentar el riesgo de enfermedad por estreptococos en lechones.
|
Posibilidad de enfermedad = [(CASOS0,1-10%/PORTADORES0-100%)1× Desencadenante de virulencia desconocido] + COINFECCIONES%?2+PRIVADO DE CALOSTRO%?3 + ESTRÉS (transporte y mezcla de camadas)0-30%4 + ESCASA VENTILACIÓN%? + MANEJO DE TEMPERATURA%? + OTROS? - ANTIBIÓTICOS90%? - BACTERINAS AUTÓGENAS0-30%?5 - CONTACTO PREVIO S. suis%?6 - ADITIVOS PIENSOS%?7 - OTROS? |
1Es ampliamente conocido que los casos y el tamaño del brote varían mucho, mientras que la prevalencia de las cepas virulentas de S. suis puede ser aún elevada.
2La influenza porcina aumenta la susceptibilidad (Meng et al. 2015; Meng et al., 2019) y el PRRSv, el circovirus respiratorio porcino, Bordetella bronchiseptica, S. suis o Haemophilus parasuis pueden incrementar la incidencia de la enfermedad, el porcentaje de pulmones con lesión, la gravedad de las lesiones y una resolución más lenta que con una infección de un solo patógeno (Segura et al., 2020).
3Los cerdos nacidos por cesárea y privados de calostro se usan a menudo para modelos experimentales de S. suis (Ferrando et al., 2014; Dekker et al., 2017). Aunque todavía se desconoce el nivel o umbral de consumo de calostro necesario para influir en la susceptibilidad.
4Algunos modelos que incluyen factores estresantes aumentaron la tasa de éxito del modelo de infección (Swildens et al., 2004; Swildens, 2009; Ferrando et al., 2015).
5Hopkins et al. (2019) analizaron 24 estudios de campo de cohortes por regresión de Cox y regresión logística donde la efectividad de la vacuna autógena en general fue del 27% y 21%, respectivamente. Corsaut et al., (2021), concluyeron que un programa de vacunación autógena para cerdas y primerizas podría aumentar los anticuerpos, pero la inmunidad maternal no duró suficientemente para proteger a los lechones tras el destete. Solo hay tres experimentos de campo disponibles que muestran la eficacia de las bacterinas autógenas fabricadas por empresas autorizadas (Torremorell et al., 1997; Hopkins et al., 2019; Corsaut et al., 2020).
6La exposición a S. suis puede ser beneficiosa. Un desafío previo a baja dosis con S. suis usada para vacunar a cerdos, pero no la vacunación previa contra PRRSv, resultó en una menor incidencia de enfermedad por estreptococos en un modelo de coinfección con PRRSv y S. suis (Schmitt et al., 2001). La infección por diferentes serotipos de S. suis o la coinfección simultánea (serotipos 2 y 9) pueden afectar la mortalidad y la carga bacteriana; la carga y mortalidad del serotipo 2 fueron menores en cerdos expuestos a los dos serotipos (Dekker et al., 2017).
7Correa-Fiz et al. (2020) informaron que los ácidos grasos de cadena media combinados con un antiinflamatorio natural mostraron resultados equivalentes a la amoxicilina para una menor prevalencia de signos clínicos compatibles con S. suis.
Sin un modelo que imite la infección natural, está claro que todavía necesitamos un mayor conocimiento sobre la susceptibilidad del huésped y los factores desencadenantes de la virulencia de S. suis. Los autores de las investigación más reciente sobre S. suis mencionados anteriormente, indican que las primeras etapas de colonización son clave. Durante estas etapas, el patógeno compite con la microbiota, resiste la inmunidad local y finalmente se adhiere y cruza la barrera epitelial de la mucosa. El papel potencial de las mucosas con su salud e inmunidad, incluidas las interacciones entre mucosa, “biofilm” y S. suis, abre la puerta a considerar los aditivos para piensos y las intervenciones nutricionales. Sin embargo, carecemos todavía de pruebas sólidas.
S. suis está muy presente en la cavidad oral de los cerdos y la transmisión tiene lugar a lo largo de las fases productivas. Murase et al. (2019) mostraron que la microbiota de la saliva incluye Streptococcus spp. al 16,9% (50,1% S. suis) en lechones lactantes, 18,2% (51,8% S. suis) en lechones destetados y 9,9% (62,6% S. suis) en cerdas. Recientemente, analizamos 15 lechones de 3 camadas diferentes y evaluamos la carga del serotipo 9 de S. suis en tonsilas (figura 2). El 60% de los lechones estaban por debajo del límite de detección de qPCR antes del destete, pero todos pasaron a portadores el día 6 post-destete. La transmisión y/o la carga de S. suis aumentaron después del destete. Por otro lado, 2 lechones que enfermaron de forma natural, eran procedentes de la misma camada pero destinados a corrales diferentes, y ya eran portadores antes del destete. Dichos resultados alinean bien con los hallazgos anteriormente publicados (Segura et al., 2020).
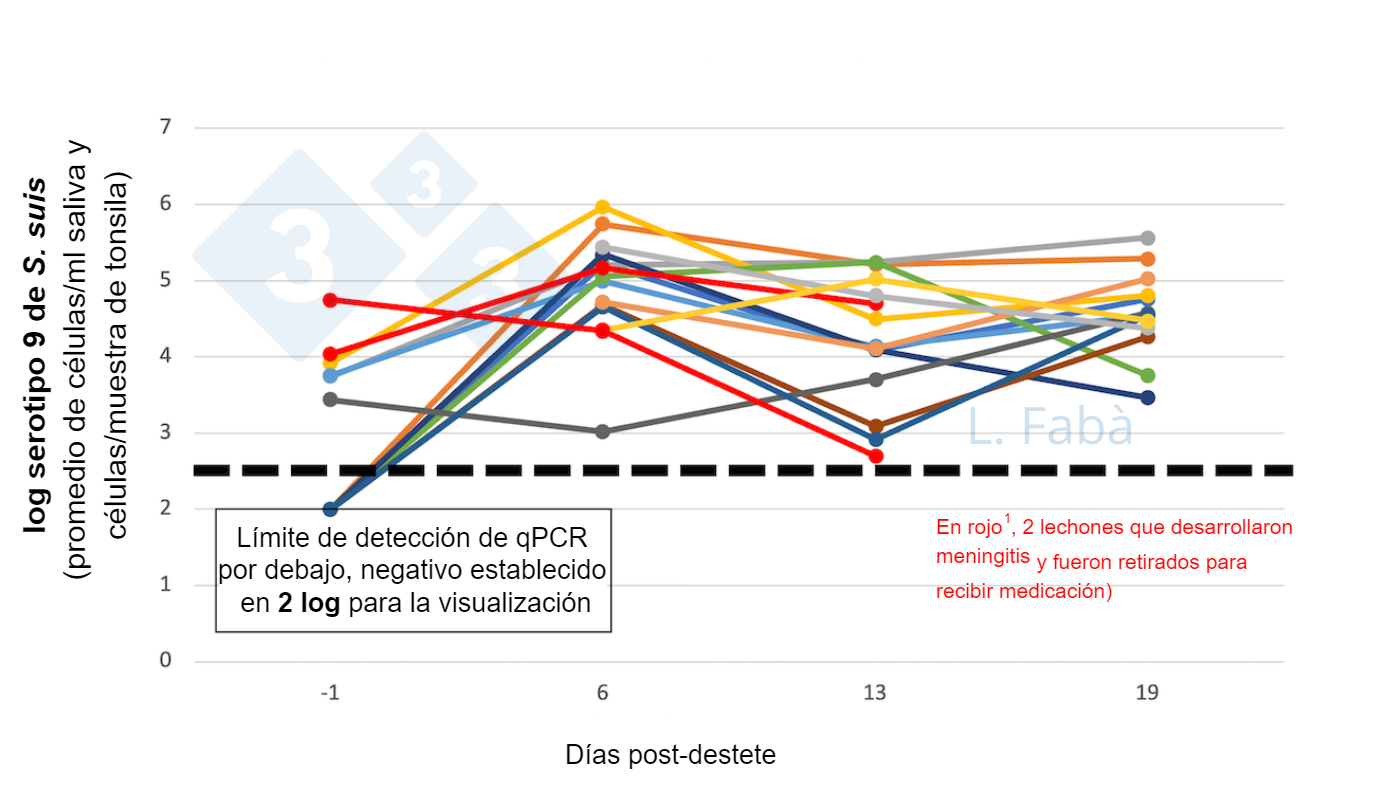 1Fue coincidencia que 2 lechones fueran diagnosticados con signos de meningitis (días 10 y 14; cerdos en rojo). Los lechones recibieron tratamiento antibiótico y se retiraron de los corrales. La carga más baja en uno de los lechones el día 13 representa la reducción tras el tratamiento con antibióticos. Posteriormente, no se recogieron más muestras de esos lechones.
1Fue coincidencia que 2 lechones fueran diagnosticados con signos de meningitis (días 10 y 14; cerdos en rojo). Los lechones recibieron tratamiento antibiótico y se retiraron de los corrales. La carga más baja en uno de los lechones el día 13 representa la reducción tras el tratamiento con antibióticos. Posteriormente, no se recogieron más muestras de esos lechones.
Hasta la fecha, se desconoce si la reducción de la proporción de portadores (transmisión), la carga tonsilar y la colonización gastrointestinal desde la lactación hasta la transición puede disminuir el riesgo de enfermedad, por lo que es necesaria más investigación. La cavidad oral y la mucosa en humanos se consideran como una parte integral de la salud general, incluido el riesgo de septicemia y el bienestar (Lockhart et al., 2009; Zawadzki et al., 2016). Algunos extractos de plantas y ácidos grasos tienen actividad antiestreptocócica in vitro (Aguiar et al., 2018; Kovanda et al., 2019). De hecho, la higiene oral en humanos reduce el riesgo de enfermedad por estreptococos (Okuda et al. 1998, Paju y Scannapieco, 2008; Müller, 2015). Dicha evidencia es difícil de demostrar en cerdos, ya que aún no existe un modelo de infección natural y debe evaluarse en condiciones comerciales y a gran escala.
Wells et al. (2019) recientemente reportaron diferencias entre el microbioma tonsilar de lechones de camadas sanas y camadas con casos de S. suis. Además, Ferrando et al., (2015) demostraron que la glucosa baja pero los glucanos altos en la mucosa pueden desencadenar la virulencia de S. suis, lo cual es importante ya que la glucosa se absorbe rápidamente pero los glucanos de la dieta persisten en la cavidad orofaríngea. Al observar el esquema de la hipótesis (figura 1), los factores nutricionales pueden convertirse en otra pregunta empírica que contribuya a la lista, justificando más investigación.
La enfermedad se asocia empíricamente con lechones sanos y pesados, que consumen grandes volúmenes de leche y se adaptan mal al pienso sólido tras el destete. Tienen un consumo inadecuado de nutrientes al principio del post-destete con cierta atrofia de las vellosidades y, seguidamente (3-7 días después), consumen bruscamente grandes cantidades de pienso. Esto contribuye al daño del tejido intestinal, que incluye inflamación, reducción del suministro de oxígeno, incremento de la permeabilidad del epitelio y cambios en la microbiota. Algunas investigaciones indican que estrategias nutricionales, como la inclusión elevada de alfalfa, redujeron S. suis (Zhang et al., 2016) y una fuente diferente de Cu (hidroxicloruro comparado con Cu como sulfato 160 mg/kg) redujo Streptococcus spp en el intestino grueso (Villagómez-Estrada et al., 2020). Recientemente, Correa-Fiz et al. (2020) reportaron que los ácidos grasos de cadena media (AGCM) combinados con un antiinflamatorio natural mostraron resultados equivalentes a la amoxicilina para reducir la prevalencia de signos clínicos compatibles con enfermedad por S. suis em comparación con el péptido de lisozima, AGCM solo i AGCM+péptido de lisozima. Asimismo, AGCM+antiinflamatorio tuvo mayor diversidad de microbiota nasal y, a su vez, mostró menor prevalencia de enfermedad por S. suis. En su ensayo, el número de parto de las cerdas influyó en la composición de la microbiota tanto en las heces como en el conducto nasal, lo que vuelve a poner de relieve la importancia de un abordaje completo desde la cerda hasta el lechón.
Sigue sin estar claro si los aditivos para piensos pueden ser una buena alternativa a los antimicrobianos en la situación actual de S. suis, pero datos recientes justifican más investigación. La creación de programas nutricionales transversales que influyan la microbiota y la mucosa hacia el correcto equilibrio debería incorporarse también en el programa de control de S. suis.
