Caso clínico: Fallo reproductivo
26-mar-2012 (hace 13 años 10 meses 24 días)
Descripción de la explotación
Se trata de una cooperativa que posee 2 unidades de producción de lechones (UPL) y un centro de inseminación artificial (CIA), ubicada en el estado de Paraná (Brasil). Las UPLs están localizadas a 60 km una de otra y el CIA a 35 km de la UPL 1 y 60 km de la UPL 2 (ilustración 1).
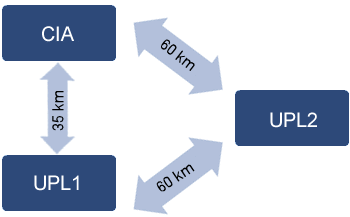
Ilustración 1. Distancia entre las granjas UPL y el CIA.
En marzo de 2011 hay un informe de los gerentes de las UPLs donde se reflejaba un incremento de las repeticiones en hembras (a los 17-28 días, cíclicos y acíclicos, con una repetición del 22%) y descargas vulvovaginales con aspecto mucoso, de color blanco a marrón (chocolate) horas después de la inseminación artificial. La mayor incidencia se produjo en las nulíparas aunque también afectó a las cerdas multíparas. Las madres desmamadas son alojadas en jaulas con una temperatura controlada a 21 °C y una humedad relativa entre 60-70% siguiendo en la misma zona por lo menos durante las primeras 7-8 semanas de gestación.
Este problema ocurrió en las dos granjas. Por medidas de bioseguridad, se visitó primero el CIA y después las UPLs, debido a los protocolos de la empresa de consultoria. La sospecha clínica fue la presencia de micotoxinas, por lo que la empresa de nutrición realizó una toma de muestras, seguimiento y cuantificación de las mismas, no detectándose en las materias primas.
Estado sanitario
En las UPLs, los animales son negativos en cuanto a seroconversión de PRRS y Aujeszky y positivos a Mycoplasma hyopneumoniae. Adoptan en sus rutinas medidas de bioseguridad adecuadas que les permiten un buen control sanitario con una baja incidencia de signos clínicos que indiquen la presencia de patologías agudas o crónicas.
La reposición de las granjas comerciales se hace a partir de la adquisición de hembras F1 desmamadas de la granja multiplicadora que tiene sus propias bisabuelas y abuelas y la adquisición del material genético, que cumple las bases de la mejora genética, se produce mediante la compra de semen de abuelos y bisabuelos mediante un programa preestablecido. El CIA de la empresa produce 7.500 dosis al mes.
El CIA
Se trata de un CIA moderno, semi-automatizado, que utiliza en sus procesos materiales desechables. Los verracos son libres de anticuerpos de PRRS, Aujeszky, Leptospirosis, Brucelosis. Son vacunados cada 6 meses contra Erisipela, Leptospirosis i Parvovirosis. Están alojados en corrales de 7,5 m² con una temperatura regulada a 21 °C (con una variación entre máxima y mínima de 4-6 °C), humedad relativa de 60-70 % y 12–14 h de luz.
La sala de extracción presenta un foso de recogida y las dependencias del laboratorio están debidamente separadas en zonas limpias, sucias e intermedias. El propio laboratorio produce agua osmosificada mediante ósmosis inversa para producir las dosis. Todos los equipos son de acero inoxidable, y se utilizan materiales de un solo uso para la manipulación del semen. Las dosis son envasadas automáticamente en tubos de plástico.
Visita técnica
Durante la visita al CIA se tomaron muestras de agua, semen puro y diluido, y materiales que forman parte del proceso de manipulación y producción de las dosis de semen, tal como muestra la tabla 1, con sus respectivos resultados.
Tabla 1. Bacteriología.
| Muestra | UFC / mL – Agente |
| Agua recién osmosificada | Sin crecimiento bacteriano |
| Agua recogida del homogenizador con diluyente | 36 UFC |
| Laminocultivo de agua con diluente | Crecimiento y aislamiento de Burkholderia cepacia |
| Agua con diluente | Crecimiento y aislamiento de Burkholderia cepacia |
| Homogeneizador bolsa/hélice | Crecimiento y aislamiento de Burkholderia cepacia |
| Tubo de recogida – Blister | Sin crecimiento bacteriano |
| Recipiente de descanso para el dispensador | Sin crecimiento bacteriano |
| Bote de pajuelas | 10 UFC |
| Boquilla del dosificador | Sin crecimiento bacteriano |
(UFC) Unidad formadora de colonias
Tabla 2. Bacteriología en semen diluido
| Muestra | Agente aislado |
| Semen diluido– 1 | Burkholderia cepacia |
| Semen diluido– 2 | Burkholderia cepacia |
| Semen diluido– 3 | Burkholderia cepacia |
| Semen diluido– 4 | Burkholderia cepacia |
Resultados
De este modo se verificó que había una contaminación previa en el tanque del homogenizador (en la hélice y en la bolsa de plástico desechable que recubre el tanque). La contaminación se estableció también en las dosis producidas en ese momento debido a las altas concentraciones existentes en el tanque (bolsa de plástico y hélice) siendo aislada la misma cepa que en el tanque de dilución.
1ª Conclusión: No se estaba descartado la bolsa de plástico del tanque después de cada uso siendo renovado apenas una vez por semana. La recomendación consiste en cambiar todo el material descartable después de cada producción de dosis.
Visita en una de las granjas (UPL 1)
Durante la visita a la UPL, se tomó muestras de la primera orina, descartando el primer chorro, recogiendo la porción intermedia en recipientes estériles y manteniendo las precauciones básicas de higiene en todo el procedimiento. En seguida se preparó y se envió el material en refrigeración para su procesamiento en laboratório.
Se observó que el 15% de las muestras de orina presentaron un crecimiento bacteriano de Burkholderia cepacia. Se trata de una bacteria que se suele encontrar en el suelo o agua y puede vivir durante largos periodos en ambientes húmedos. Algunos estudios han relacionado la presencia de Burkholderia cepacia en humanos con fibrosis quística presente en patologías respiratorias.
También se seleccionó una nulípara con presencia de secreciones vulvovaginales abundantes que, en la evaluación clínica, mostró todos los parámetros fisiológicos normales, sin ninguna indicación de estado febril ni pérdida de apetito (la temperatura rectal era de 38,7 °C). Siendo la única observación clínica la presencia de secreciones mucosas y la presencia de hilos de moco e hiperemia en la mucosa vaginal. La cerda había sido inseminada recientemente (recibió la primera dosis de semen durante la mañana y se procedió a la recogida al final de la tarde).
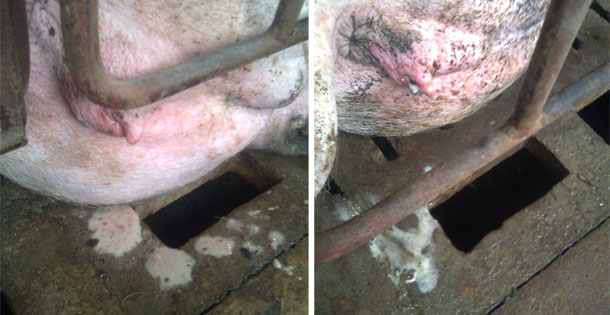
Figura 1. Las imágenes muestran las secreciones vulvares.
Se tomaron hisopos de dichas secreciones para realizar un aislamiento bacteriano. Los resultados se muestran en la siguiente tabla:
Tabla 3. Resultados del aislamiento bacteriano.
| Muestra | Agente aislado |
| Mucosa vaginal | Crecimiento y aislamiento de Burkholderia cepacia |
| Mucosa del cérvix | Crecimiento y aislamiento de Burkholderia cepacia |
| Mucosa del útero | Crecimiento y aislamiento de Burkholderia cepacia |
| Mucosa de la vejiga | Sin crecimiento bacteriano |
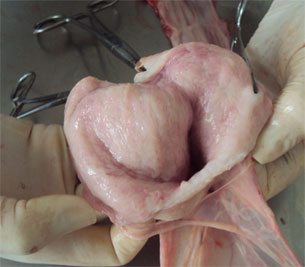
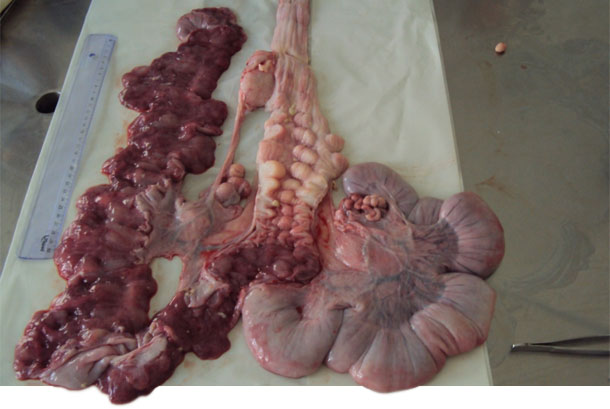
| Figura 2. Aparato reproductivo de una nulípara. | Figura 3. Apertura del cérvix para la recogida de la secreción con un hisopo. |
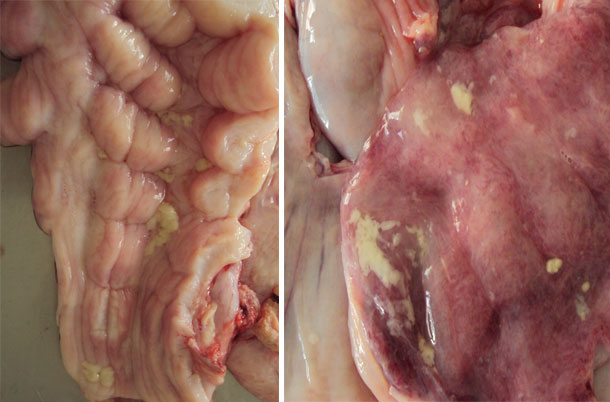
Figura 3. Presencia de moco en la mucosa del cérvix y la mucosa uterina.
|
|
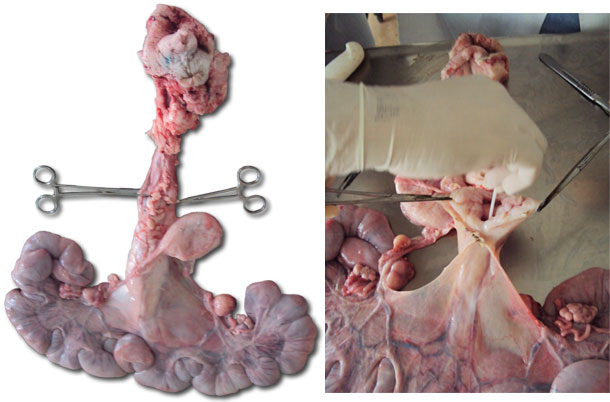
Otras hembras recién inseminadas con los mismos síntomas clínicos fueron seleccionadas para la recogida de secreciones vulvovaginales mediante hisopos profundos utilizando espéculos descartables para una mejor apertura de la mucosa vaginal e introducción del swab. Se seleccionó una hembra nulípara con los mismos signos clínicos y una inseminación completa para ser sacrificada y necropsiada. Se extrajo todo el aparato genital y, al abrirlo, se tomaron muestras de moco purulento del cérvix, vagina y cuernos uterinos para el cultivo y aislamiento bacteriano.
2ª Conclusión: En todo el material recogido para aislamiento bacteriano se detectó la misma bacteria: Burkholderia cepacia.
Estrategias de manejo que fueron adoptadas:
- Recurrir a medicación inyectable con ceftiofur a las hembras con problemas;
- Descartar las hembras que repitiesen celo con presencia de secreciones;
- Adoptar el procedimiento de autoclavar todo el material de laboratorio contaminado;
- Utilizar en el tanque de dilución una bolsa desechable cada día;
- Aumentar los cuidados básicos de higiene con el personal de recogida y laboratorio, empezando a utilizar mascarillas desechables durante las actividades de preparación de las dosis de semen;
- Visitas al centro y las granjas cada 15 días con recogida de material de todas las fases de proceso de producción del semen hasta que las condiciones volviesen a la normalidad;
- Evitar almacenar las dosis de semen durante más de 72 horas;
- El problema del laboratorio fue solucionado en tres semanas, pero las pérdidas se alargaron durante 10 semanas.
El diluyente utilizado tenía antibióticos, pero las bacterias eran resistentes, tal como puede verse en el antibiograma, tal como puede verse en la tabla siguiente. También se solicitó la adición de moléculas antimicrobianas sensibles a B. cepacia en los diluyentes.
Tabla 4. Antibiograma-RG 131
| Antibióticos | Burkholderia cepacia (agua con diluente) |
Burkholderia cepacia (semen 88645 diluido) |
||
| Halo de inhibición | Sensibilidad | Halo de inhibición | Sensibilidad | |
| Amoxicilina 10 mcg | 6 mm | R | 6 mm | R |
| Ampicilina 10 mcg | 6 mm | R | 6 mm | R |
| Apramicina 15 mcg | 16 mm | S | 16 mm | S |
| Ceftiofour 30 mcg | 26 mm | S | 26 mm | S |
| Colistina 10 mcg | 6 mm | R | 6 mm | R |
| Enrofloxacina 5 mcg | 26 mm | S | 26 mm | S |
| Espectinomicina+Lincomicina 100+9 mcg | 14 mm | R | 14 mm | R |
| Florfenicol 30 mcg | 16 mm | I | 16 mm | I |
| Gentamicina 10 mcg | 6 mm | R | 6 mm | R |
| Neomicina 30 mcg | 6 mm | R | 6 mm | R |
| Norfloxacina 10 mcg | >30 mm | S | >30 mm | S |
| Penicilina G 10 um | 6 mm | R | 6 mm | R |
| Sulfazotrim 25 mcg (Sulfametazina+Trimetropim) | 6 mm | R | 6 mm | R |
LEYENDA: S = Sensible; R = Resistente; I = Intermedio
Método: Difusión en ágar
Referencia: CLSI (Clinical And Laboratory Standards Institute)