Actualización sobre la epidemiología de PCV2 e implicaciones
30-nov-2012 (hace 13 años 3 meses 9 días)
¿Es el PCV2 un virus “nuevo” en la cabaña porcina?
Tenemos conocimiento de la existencia del PCV2 desde 1998 a raíz de la búsqueda de la causa de brotes clínicos descritos a partir de 1991. Estos brotes cursaban principalmente con retraso en el crecimiento e incremento de mortalidad en cerdos a finales de transición y primera parte del engorde, denominando a esta condición patológica como síndrome multisistémico de desmedro post-destete (en la actualidad se ha propuesto denominarlo enfermedad sistémica asociada a PCV2, ES-PCV2). Los principales brotes epidémicos tuvieron lugar en Europa y Asia entre 1998 y 2004 mientras que en el continente americano sucedieron entre 2004 y 2007. Sin embargo, tenemos constancia mediante estudios retrospectivos de la existencia de animales infectados por PCV2 al menos desde 1962 y de animales con ES-PCV2 desde al menos 1985.
¿Es el PCV2 un virus frecuente?
Desde la primera descripción de PCV2 en 1998, se ha evidenciado la presencia del virus en todos los países en los que se ha buscado, demostrando que se trata de un virus ubicuo a nivel mundial. De la misma manera, prácticamente el 100% de granjas comerciales están infectadas por PCV2 y casi la totalidad de los cerdos son seropositivos a PCV2 al final del engorde. También se ha descrito la distribución mundial de ES-PCV2 tal y como se muestra en la figura 1.
Figura 1. Países en los que se ha diagnosticado ES-PCV2 (en amarillo).
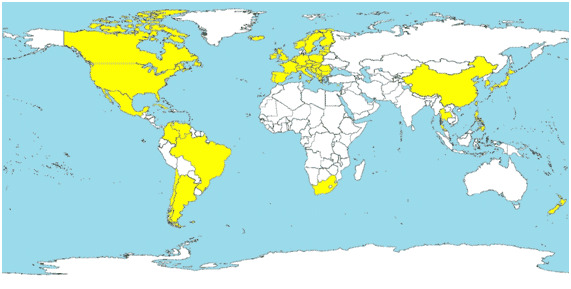
¿Cómo se transmite el PCV2?
Los animales infectados por PCV2 eliminan el virus por todas las vías de excreción examinadas, detectándose en cavidad nasal, secreción oro-tonsilar, secreción bronquial, saliva, secreción ocular, heces, orina, leche y semen. La ruta de transmisión principal es la oro-nasal, aunque el PCV2 posee una elevada resistencia en el ambiente y es posible incluso la transmisión aerógena.
En una granja, los animales reproductores son los que mantienen la infección y la transmiten a la descendencia habitualmente por vía horizontal durante la lactación. No obstante, también se ha descrito la transmisión vertical en este grupo de animales.
La información referente a la dinámica de infección por PCV2 dentro de una granja puede consultarse en el artículo previo Efecto de la viremia por circovirus porcino tipo 2 (PCV2) sobre parámetros productivos.
La potencial capacidad infectiva del semen únicamente se ha demostrado en condiciones experimentales, dándose tras la inoculación intraperitoneal de semen infectado en lechones o reproduciendo enfermedad reproductiva asociada a PCV2 tras inseminar cerdas con semen experimentalmente infectado. Hasta la fecha no se ha descrito la transmisión de infección a la cerda ni a los fetos tras la inseminación artificial con semen naturalmente infectado. Así pues, estas experiencias sugieren que la infección a través del semen no es un hecho frecuente ni sencillo ya que la carga vírica habitual en el campo quizás no sea lo suficientemente elevada como para resultar infectivo.
¿A qué se debe su comportamiento patogénico relativamente reciente?
No existe una explicación simple al hecho de que PCV2, un virus ubicuo, se asociara a la aparición epidémica de una enfermedad de forma relativamente súbita y global. Es muy posible que existan distintos aspectos relacionados con la producción porcina y el comercio internacional que puedan explicarlo parcialmente. No obstante, lo que si se conoce actualmente es que este cambio de presentación clínica esporádica a epidémica se asocia a un cambio en la prevalencia de genotipo PCV2a a PCV2b. Un ejemplo de esta situación se muestra a partir de datos de España en la Figura 2. Por otro lado, existen algunos estudios que muestran mayor probabilidad de reproducir la enfermedad utilizando inóculos de PCV2b que PCV2a.
Figura 2. Frecuencia de detección de PCV2a y PCV2b en España (adaptado de Cortey et al., 2011 Vet J).
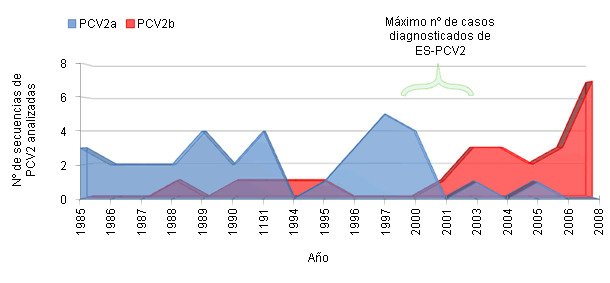
Un dato curioso en este sentido es la existencia de protección cruzada que confiere el genotipo “a” frente al “b”, dado que las vacunas comerciales existentes en la actualidad están basadas en virus del primer genotipo.
¿Qué factores pueden influir en la expresión de las PCVDs1?
El cuadro clínico que puedan desarrollar los animales depende de múltiples factores como pueden ser su edad, su protección inmunitaria pasiva o activa, presión de infección, carga vírica individual, ruta de transmisión, situación fisiológica (momento de gestación), además de la presencia de infecciones concomitantes y factores ambientales. Así, múltiples estudios epidemiológicos han descrito una serie de factores de riesgo asociados al desarrollo de la ES-PCV2 los cuales se describen en la Tabla 1 (cabe aclarar que se trata de un recopilatorio de resultados obtenidos en diferentes estudios, generalmente con un objetivo exploratorio, donde en ocasiones la asociación biológica no es a priori evidente en alguno de los casos, pudiendo tratarse de efectos espurios).
Tabla 1. Factores relacionados con el incremento o disminución del riesgo de desarrollar ES-PCV2.
| Factores que incrementan el riesgo de padecer ES-PCV2 | Factores que disminuyen el riesgo de padecer ES-PCV2 |
PCV2:
Bioseguridad:
|
Instalaciones:
Manejo:
Tratamientos/vacunaciones:
Bioseguridad:
|
1PCVDs: enfermedades asociadas a circovirus porcino tipo 2 (siglas procedentes del inglés: Porcine Circovirus Diseases).
